FAG Originalartikkel
Immunhistokjemisk påvisning av mismatch repair-proteiner
Hovedbudskap
- Fire optimaliserte protokoller for primærantistoffene anti-MLH1, anti-PMS2, anti-MSH2 og anti-MSH6 ble implementert ved Enhet for immunhistokjemi, Avdeling for patologi, St. Olavs hospital.
- De optimaliserte protokollene ga mer distinkt kjernefarge og mindre bakgrunnsfarge, hvilket gjorde det lettere å stille riktige diagnoser ved eventuelle bortfall av mismatch-repair-proteiner.
- Reproduserbarheten ble bedre ved bruk av de nye protokollene, særlig for PMS2 og MSH6.
Artikkelen er basert på en bacheloroppgave utført ved NTNU Trondheim i 2018.
Immunhistokjemisk påvisning av mismatch repair-proteiner.pdf(412 KB)
I Norge er tykk- og endetarmskreft, eller tarmkreft, den nest hyppigste kreftformen (1,2). Det ses en familiehistorie med tarmkreft i flere av tilfellene (2). Lynch syndrom (LS), også kjent som hereditær non-polypøs tykk- og endetarmskreft (HNPCC), er det vanligste arvelige kreftsyndromet. Dette syndromet er forbundet med økt risiko for tarmkreft, og særlig økt risiko for å utvikle kreft i ung alder. I tillegg ses det en økt forekomst av flere andre primære tumorer i ventrikkel, hjerne, bukspyttkjertel, livmorhalsslimhinne, prostata og eggstokker (2-4).
Mismatch repair (MMR)-proteiner er enzymer som spiller en sentral rolle i å fremme stabilt DNA. Enzymene gjør dette ved å reparere DNA-replikasjonsfeil og hemme rekombinasjoner mellom ikke-identiske DNA-sekvenser etter replikasjon. Tap av disse proteinene, eller mutasjoner i genene for MMR-proteinene, kan resultere i opphopning av spontane mutasjoner i arvematerialet (5,6). Over tid kan opphopningen påvirke produksjonen av viktige cellulære proteiner, som igjen kan føre til kreft (3).
MLH1, PMS2, MSH2 og MSH6 er MMR-proteiner som normalt uttrykkes i cellekjerner. Mutasjon i et av genene som koder for disse proteinene kan lede til LS. MLH1 og MSH2 er de vanligste genene å ha mutasjon i ved LS (7). Tap av MLH1- eller MSH2-proteinene ledsages som regel alltid av tap av heterodimer partner, henholdsvis PMS2 eller MSH6. Imidlertid fører ikke tap av PMS2 eller MSH6 til tap av MLH1 eller MSH2. Tap av PMS2, MSH2 og/eller MSH6 har sammenheng med mulig LS. Tap av kun MLH1 kan indikere sporadisk forekomst av kreft, eller potensielt LS (8-10). Vevsprøver kan farges med immunhistokjemi for å gi en indikasjon på om det foreligger en genfeil som har ført til eventuelt tap av disse proteinene (4).
Ved Enhet for immunhistokjemi, Avdeling for patologi, St. Olavs hospital, var det et ønske om å prøve ut nye primærantistoff for MLH1, PMS2, MSH2 og MSH6, ettersom de eksisterende primærantistoffene hadde varierende fargekvalitet, spesielt for PMS2 og MSH6. Den varierende kvaliteten førte til at fargeresultatene kunne være vanskelig å tolke. For å oppnå optimalt resultat ved immunhistokjemisk farging, er det viktig å optimalisere protokollene for hvert primærantistoff.
Hensikten med studien var å sikre høy kvalitet og pålitelige resultater ved å optimalisere protokoller for immunhistokjemisk farging med primærantistoffene anti-MLH1, anti-PMS2, anti-MSH2 og anti-MSH6 på BenchMark Ultra (Ventana/Roche). Utprøvingen ble utført ved Enhet for immunhistokjemi, Avdeling for patologi, St. Olavs hospital.
Materiale og metode
Prøvemateriale
Prøvematerialet som ble benyttet i studien var 17 formalinfikserte, parafininnstøpte vevsprøver med kjente diagnoser som tidligere var farget og diagnostisert ved avdelingen. Prøvene ble hentet fra diagnostisk biobank ved avdelingen. Utvalgskriteriet var at de inneholdt både tumor- og normalvev. Åtte av prøvene hadde normalt proteinuttrykk for MLH1, PMS2, MSH2 og MSH6. De resterende ni hadde tap av MLH1 og PMS2, eller MSH2 og MSH6. Prøvene var hovedsakelig fra tykktarm, men det ble i tillegg anvendt vevsprøver fra uterus, tynntarm, rektum og ventrikkel, for å prøve ut fargingen på flere vevstyper. Ettersom prøvene ble benyttet til kvalitetssikring av nye analyser, var det ikke nødvendig med samtykke fra pasientene.
Kontroller
Det ble benyttet kontroller for å kontrollere den tekniske kvaliteten til immunfargingene. Disse kontrollene lages ved avdelingen. Kontrollmaterialet var multiblokk med formalinfiksert, parafininnstøpt vevsmateriale fra normal appendiks, tonsille, pankreas og lever. Normalvev fra disse organene skal være positivt for MLH1, PMS2, MSH2 og MSH6.
Intern vevskontroll ble også vurdert. Normalvev og tumorvev med normalt proteinuttrykk ble anvendt som positiv kontroll, mens tumor med kjent bortfall av proteinene ble brukt som negativ kontroll.
Primærantistoff
Informasjon om primærantistoffene som tidligere ble benyttet og primærantistoffene som ble anvendt i studien finnes i tabell 1.
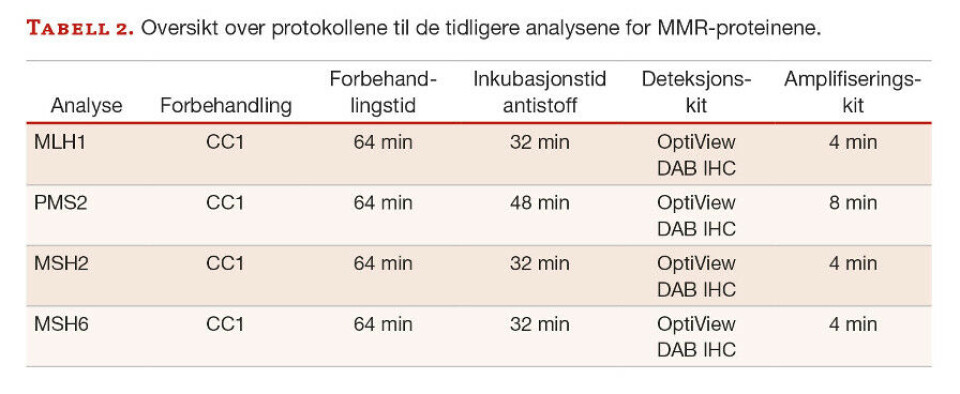
I tabell 2 ses en oversikt over de protokollene som ble benyttet på de tidligere analysene for MLH1, PMS2, MSH2 og MSH6.

Prinsipp
Immunhistokjemi (IHC) er en teknikk som benyttes til diagnostiske formål ved medisinske laboratorier. Metoden benyttes for å påvise biomarkører i ulike vev, og går ut på å lokalisere antigen i vevssnitt ved hjelp av primære antistoff som er spesifikke mot en epitop (11).
Formalin danner kryssbindinger i vevet slik at det skal holde seg stabilt. Disse kryssbindingene maskerer antigenene, og snittene må derfor forbehandles for å bryte bindingene slik at epitopene demaskeres. Heat-induced epitope retrieval (HIER) brukes til dette. Ved HIER benyttes buffer og varme for å bryte bindingene (12).
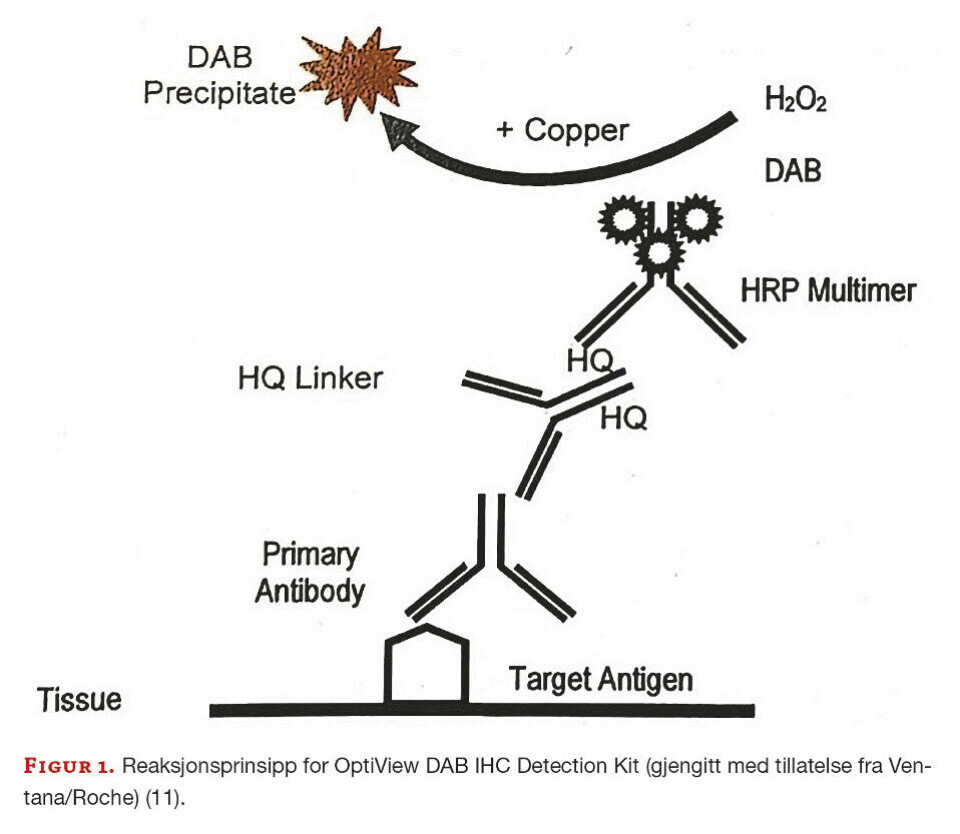
For denne studien ble primærantistoff fra mus og kanin anvendt. OptiView DAB IHC Detection Kit benytter en blanding av sekundære antistoff for påvisning av primærantistoff fra mus og kanin, se figur 1. De sekundære antistoffene er dekket av syntetiske molekyler (HQ-hapten) med høy affinitet til det tertiære antistoffet, HRP Multimer. Det tertiære antistoffet er merket med enzymet HRP (horseradish peroxidase). HRP katalyserer reaksjonen mellom H2O2 (hydrogenperoksidsubstrat) og 3,3’-diaminobenzidin tetrahydroklorid (DAB) kromogen hvor H2O2 oksiderer DAB-kromogenet. Det blir da produsert en brunfarget utfelling av DAB. Kobber vil reagere med oksidasjonsproduktet av DAB, og gjøre brunfargen mørkere og mer distinkt. Dette reaksjonsproduktet kan ses ved bruk av lysmikroskop. Ettersom MMR-proteinene finnes i cellekjernene, er det kjernene som vil farges brune (11, 13).
Fremgangsmåte
Det ble snittet 3 µm tykke snitt på SuperFrost Plus-glass. Snittene ble inkubert i varmeskap ved 60 °C i 1 time før snittene ble farget i BenchMark Ultra (Ventana/Roche). Snittene ble først varmet opp til 60 °C i 8 minutter, og så deparafinert i EZ Prep, som er en mild detergent. Videre ble snittene forbehandlet med Cell Conditioner 1 (CC1), en tris-basert buffer med basisk pH, ved 100 °C med varierende lengde. For informasjon om lengde på forbehandling, se avsnitt «Optimalisering av primærantistoffene». Deteksjonskitet som ble benyttet var OptiView DAB IHC Detection Kit (Ventana/Roche) der alle reagensene som trengs for å farge immunhistokjemi inngår. Det ble også testet ut amplifiseringstrinn med OptiView Amplification Kit (Ventana/Roche). Etter farging i instrumentene ble snittene vasket i EZ Prep for å fjerne LCS fra snittene. LCS er organiske oljemolekyler som danner et kammer for å hindre fordamping av reagenser under fargeprosessen. Videre ble snittene kontrastfarget med hematoxylin (egenprodusert ved avdelingen) i 20 sekunder, blånet i lunkent vann i 4 minutter, samt dehydrert før det ble lagt på dekkglass. Snittene ble tørket i varmeskap ved 60 °C i 10 minutter før de ble vurdert i mikroskop.
Optimalisering av primærantistoffene
Parameterne som ble optimalisert var forbehandlingstid, inkubasjonstid for primærantistoff og bruk av amplifiseringskit. Under optimaliseringen av parameterne ble det tatt utgangspunkt i leverandøren sine anbefalinger.
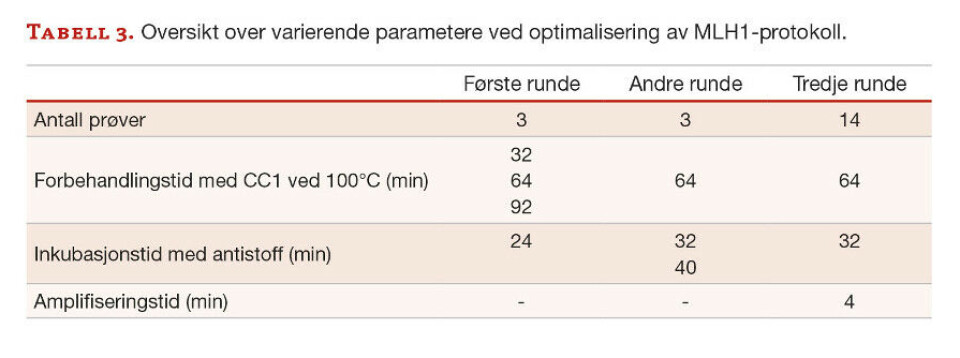
Anti-MLH1. Primærantistoffet anti-MLH1 ble utprøvd i tre runder med ulike forbehandlingstider, inkubasjonstider med antistoff og ved tillegg av et amplifiseringstrinn, se tabell 3. De samme tre prøvene ble benyttet i første og andre utprøving, mens i tredje utprøving ble det brukt 14 nye prøver.
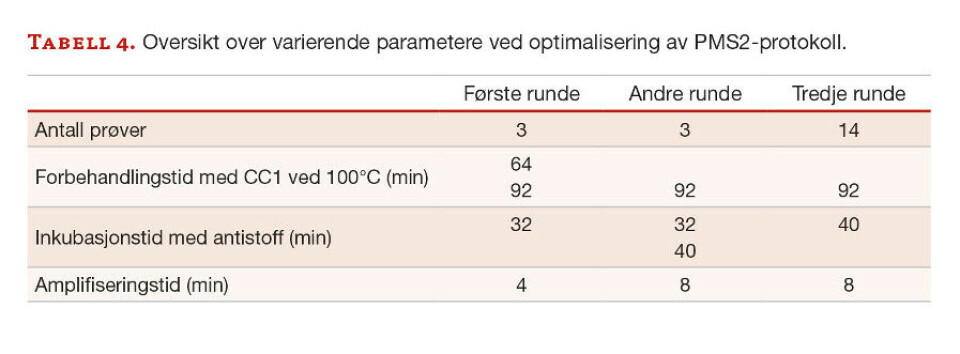
Anti-PMS2. Primærantistoffet anti-PMS2 ble utprøvd i tre runder med ulike forbehandlingstider, inkubasjonstider med antistoff og amplifiseringstid, se tabell 4. I første og andre utprøving ble de tre samme prøvene benyttet, mens i tredje utprøving ble det brukt 14 nye prøver.
Anti-MSH2. Primærantistoffet anti-MSH2 ble utprøvd i tre runder med ulike forbehandlingstider og inkubasjonstider med antistoff, se tabell 5. De tre samme prøvene ble anvendt i første og andre utprøving, mens i tredje utprøving ble det brukt 14 nye prøver.

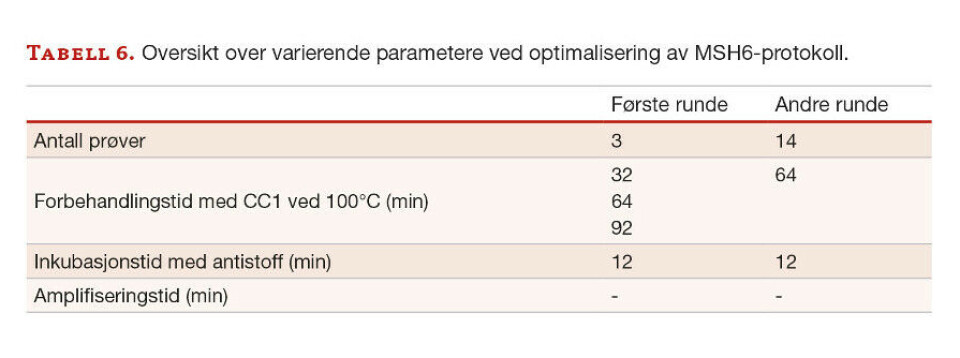
Anti-MSH6. Primærantistoffet anti-MSH6 ble utprøvd i to runder med ulike forbehandlingstider og inkubasjonstider med antistoff, se tabell 6. Det ble anvendt tre prøver ved første utprøving, og 14 andre prøver i den andre utprøvingen.
Resultater
Etter flere utprøvinger med ulike utprøvingsvariabler ble de mest optimale protokollene for primærantistoffene funnet. Ved vurdering av resultatene ble det lagt vekt på farging av riktige strukturer, fargeintensitet, hvor godt morfologien var bevart og om det var bakgrunnsfarge/uspesifikk farging. Det var ønskelig at fargingen av cellekjernene skulle være sterkt brun, distinkt og uten bakgrunnsfarge for positive resultater. Positivt tumorvev og normalvev ble farget som forventet. Negativt tumorvev fremsto som fargeløse eller blå.
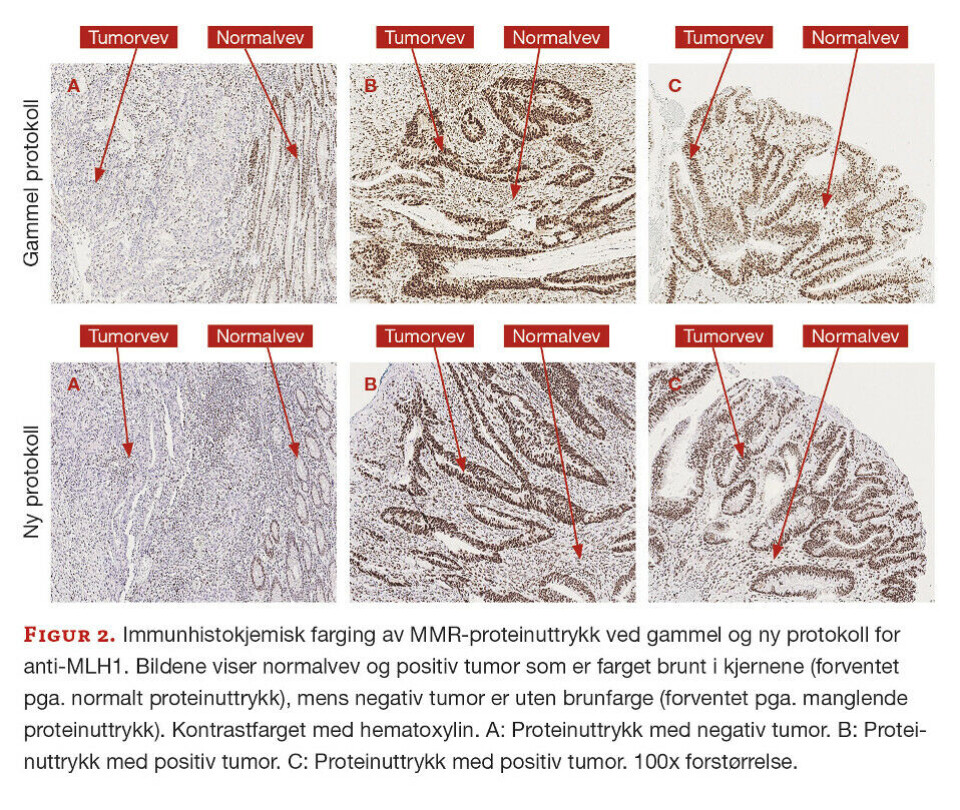
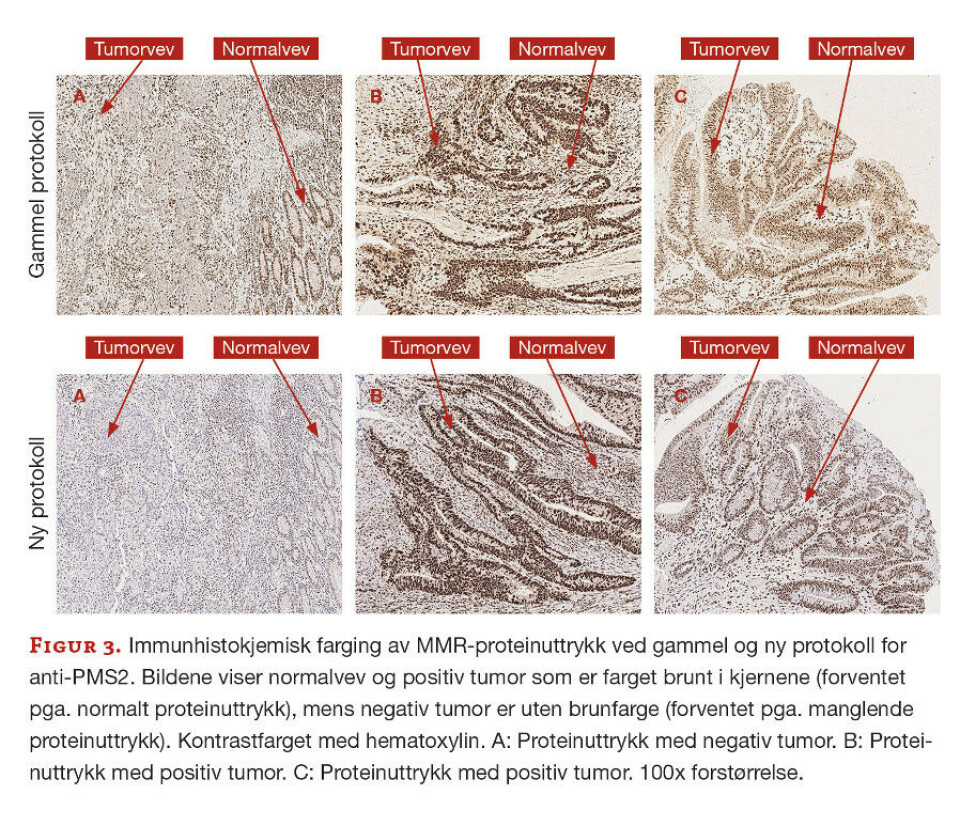
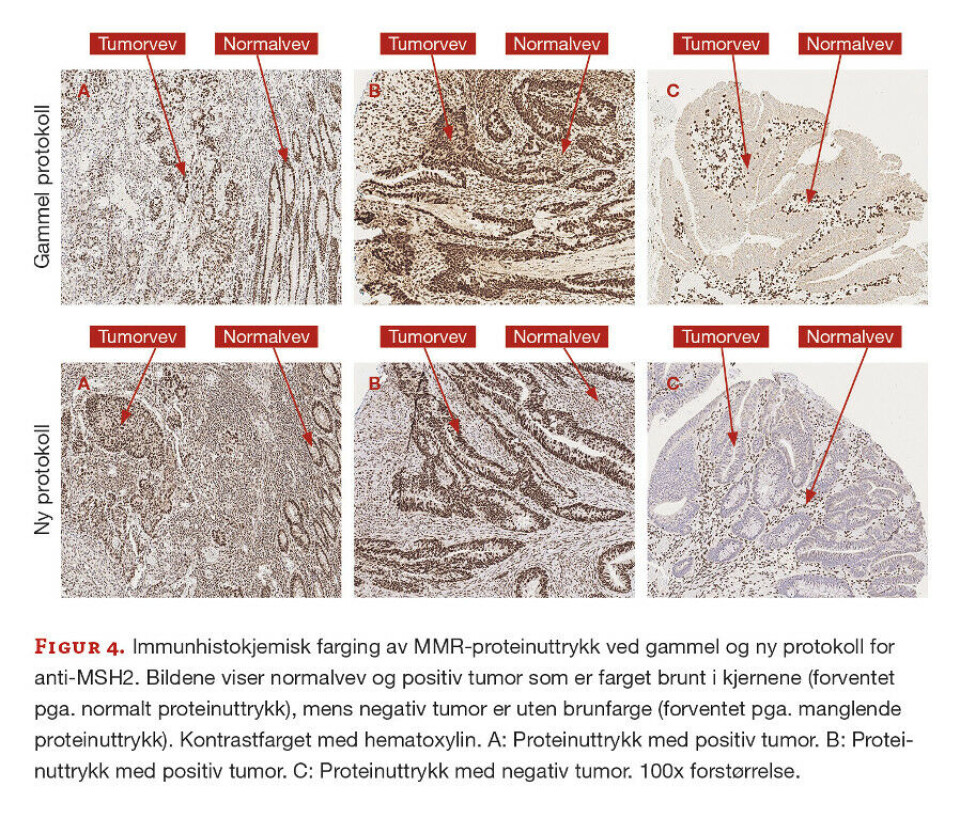
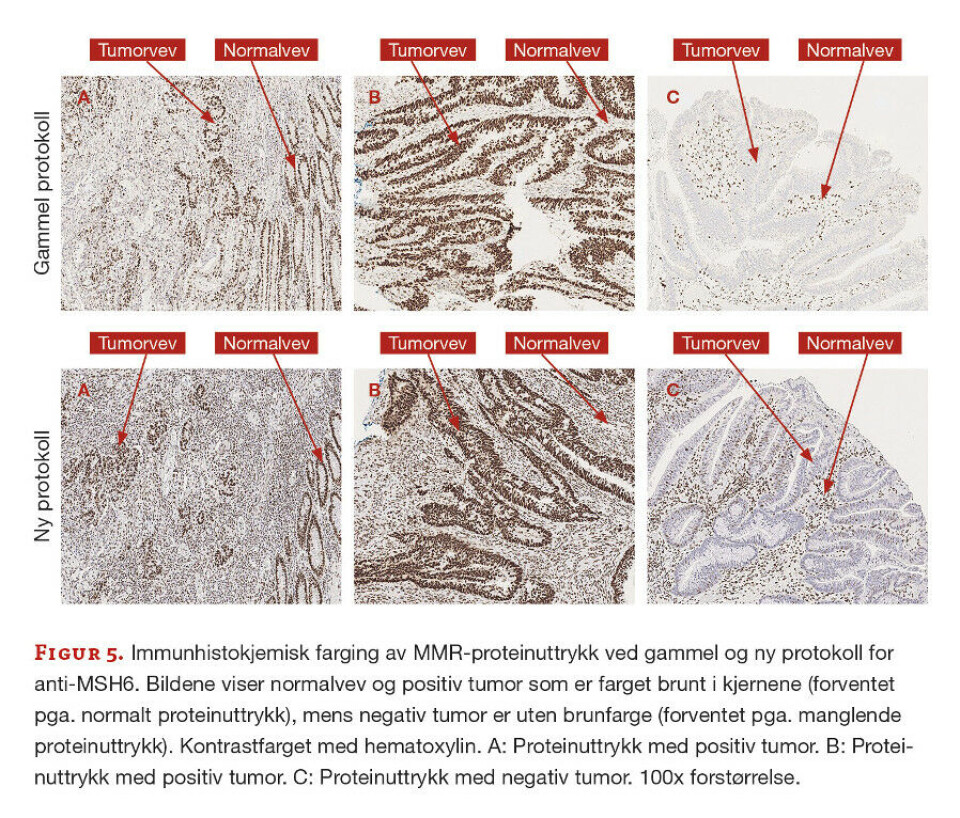
Det var totalt 17 prøver med i utprøvingen, men det er valgt ut tre representative prøver som vises med bilder fra gammel og ny protokoll. Fra tidligere vurdering var det kjent at prøve A hadde tap av MLH1- og PMS2-proteiner, prøve B hadde normalt proteinuttrykk for alle fire MMR-proteinene, mens prøve C hadde tap av MSH2- og MSH6-proteiner.
Anti-MLH1. Ved sammenligning av ny og gammel protokoll for anti-MLH1 ble forskjellen i fargekvalitet vurdert som minimal (figur 2). Patologen ved avdelingen vurderte likevel den nye protokollen som mer optimal ettersom den ga tydeligere og mer distinkt kjernefarge.
Anti- PMS2. Den nye protokollen for anti-PMS2 ga mindre bakgrunnsfarge og tydeligere kjernefarge, hvilket gjør preparatene enklere å vurdere (figur 3). Det viste seg at reproduserbarheten ved bruk av den gamle protokollen var dårligere enn ved bruk av den nye protokollen.
Anti-MSH2. For anti-MSH2 viste det seg at farging med ny protokoll ga mindre bakgrunnsfarge enn ved anvendelse av den gamle protokollen (figur 4). Den nye protokollen ga også tydeligere og mer distinkt kjernefarge.
Anti-MSH6. En tydeligere og mer distinkt farging ble også funnet ved bruk av ny protokoll for anti-MSH6 (figur 5). I tillegg var reproduserbarheten bedre mellom fargingene ved bruk av denne protokollen sammenliknet med den gamle protokollen.
Oppsummerende ble den mest optimale protokollen for anti-MLH1 med forbehandlingstid på 64 minutter, inkubasjonstid med antistoff på 32 minutter og 4 minutter med amplifisering. For anti-PMS2 ble forbehandlingstiden på 92 minutter, inkubasjonstid med antistoff på 40 minutter, og amplifisering på 8 minutter. Anti-MSH2 krevde forbehandlingstid på 64 minutter, og inkubasjonstid med antistoff på 32 minutter. For anti-MSH6 ble en protokoll med forbehandlingstid på 64 minutter og inkubasjonstid med antistoff på 12 minutter mest optimalt. Anti-MSH2 og anti-MSH6 krevde ikke amplifiseringstrinn.
Diskusjon
Formålet med denne studien var å optimalisere protokollene for primærantistoffene anti-MLH1, anti-PMS2, anti-MSH2 og anti-MSH6 til diagnostikk av Lynch. Å optimalisere protokoller er viktig for å kunne stille riktige diagnoser til pasienter med eventuelle mutasjoner i mismatch repair-gener som fører til bortfall av ett eller flere MMR-proteiner. Tap av disse proteinene kan, som tidligere nevnt, lede til Lynch syndrom.
Leverandøren oppga anbefalte protokoller for hvert av primærantistoffene, men utfra tidligere erfaringer gjort ved avdelingen er det kjent at disse ikke nødvendigvis gir optimalt resultat. Det ble derfor prøvd ut ulike protokoller med utgangspunkt i leverandøren sine anbefalinger. Det var flere faktorer som gjorde at fargeresultatene varierte, slik som vevstype, fiksering av vevet før farging, forbehandlingstid, inkubasjonstid med antistoff og eventuelt bruk av amplifiseringskit. Vevsprøvene som ble benyttet var hentet fra diagnostisk biobank og fikseringstiden til prøvene kunne dermed ikke endres i denne studien. Etter utprøving av de fire primærantistoffene var det kun protokollen til anti-MSH6 som ble lik den som er anbefalt fra leverandøren. Dette viser viktigheten av å optimalisere protokollene før de implementeres i rutinediagnostikk.
Kontrollene ble godkjent dersom de viste positivt proteinuttrykk. På grunn av for dårlig fiksering og fremføring av levervevet som ble benyttet i kontrollen, hadde denne vevsbiten negativt proteinuttrykk og ble derfor ikke vurdert. Det vil si at dersom appendiks, tonsille og pankreas viste normalt proteinuttrykk, ble kontrollfargingen godkjent. Optimalt burde det vært benyttet tumorvev med normalt proteinuttrykk, og tumor med bortfall av MMR-proteinene i kontrollen, men på grunn av lettere tilgang til restmateriale fra normalvev benytter avdelingen dette i kontrollen.
Protokollene for primærantistoffene rettet mot de ulike MMR-proteinene er vanskelige å optimalisere, ettersom disse analysene benyttes til farging av både nye prøver og prøver som har vært lagret over lang tid. De preanalytiske faktorene, slik som fiksering og fremføring, er nemlig forskjellige. Dette er en feilkilde. Med dette tatt i betraktningen, ser vi likevel at farging med de nye protokollene ga mer stabil fargekvalitet og bedre reproduserbarhet i de fleste tilfellene. Det var i tillegg enklere å tolke fargeresultatene på grunn av mer distinkt og tydelig kjernefarge, i tillegg til mindre bakgrunnsfarge. Avdelingen hadde, som tidligere nevnt, størst problemer med farging av PMS2 og MSH6-proteinene, og analysen forbedret seg med de nye protokollene.
Det er verdt å nevne at fargeresultatet avhenger av hvilket fargeinstrument som blir benyttet, reagenser, primærantistoffenes klon og fremgangsmåte. Det kan derfor være variasjoner ved ulike laboratorier. Immunhistokjemiske metoder gir ikke et bestemt fasitsvar. Fargekvaliteten og fargeresultatet vurderes individuelt ved mikroskopering av preparatene. Det vil derfor være variasjoner i hva som anses å være et optimalt resultat. Det foregår kontinuerlig et tverrfaglig samarbeid mellom bioingeniører og patologer for å oppnå det mest optimale resultatet.
Konklusjon
Det ble utarbeidet fire optimale protokoller for hvert av de fire primærantistoffene i samråd med patolog. Disse analysene ble verifisert og implementert i rutinediagnostikken av Lynch syndrom ved avdelingen i august 2018, men på grunn av for få analyser til å vurdere spesifisitet, sensitivitet og total nøyaktighet ved implementering, ble primærantistoffene prøvd ut videre ved avdelingen i perioden august 2018 - februar 2019 for å se om protokollene ga tilfredsstillende resultater på flere prøver. I denne perioden ble det farget 88 pasientprøver med de optimale protokollene. Det ble ikke oppdaget noen avvik grunnet protokollene i denne perioden og analysene er ferdig verifisert.