FAG Oversiktsartikkel
Inflammasjon og insulinresistens i fettvev
Fettvevet er et komplekst og aktivt endokrint organ.Overvekt fører til en kronisk lavgradig inflammasjon i fettvevet.Overvekt sees ofte i forbindelse med sykdommer som type 2 diabetes og aterosklerose.
Av SISSEL ÅKRA, master i bioingeniørfag, forskningsbioingeniør ved Senter for klinisk hjerteforskning, OUS, Ullevål
E-mail: UXKRSI@ous-hf.no
Inflammasjon og insulinresistens i fettvev.pdf(226 KB)
Fettvevet er ikke lenger kun å betrakte som et energilager og et næringsdepot. Fra det på slutten av 1990-tallet ble oppdaget at fettvevet produserer det pro-inflammatoriske cytokinet tumor nekrose faktor (TNF)-α, er det i dag veletablert som et komplekst og aktivt endokrint organ. Fettvevet utrykker et stort antall reseptorer som mottar signaler fra andre organer, vev og celler bl.a. fra sentralnervesystemet. Signalene kan være mangeartet, som f.eks. hormoner, fettsyrer og inflammasjonsmediatorer som cytokiner og kjemokiner.
Fettvevet skiller også selv ut en rekke cytokiner, ofte kalt adipokiner, som virker både lokalt og systemisk. Fettvevet hos normalvektige har anti-inflammatoriske egenskaper, men ved overvekt/fedme utsettes fettvevet for ulike former for cellulært stress som fører til økt produksjon av pro-inflammatoriske cytokiner. Dette medfører en kronisk lavgradig inflammasjon som er assosiert med en rekke metabolske sykdommer som insulinresistens, type 2 diabetes og aterosklerose.
Kunnskapsgrunnlag
Denne oversiktsartikkelen er basert på ikke-systematisert søk i databasen PubMed med ulike kombinasjoner av i hovedsak følgende søkeord: adipose tissue, insulin resistance, adipose tissue inflammation, visceral adipose tissue, subcutaneous adipose tissue, adipose tissue compartements, epicardial adipose tissue, pericardial adipose tissue, overweight and obesity. Søket ble avsluttet 17.12.2020 og var avgrenset til artikler publisert på engelsk.
Artiklenes relevans ble først vurdert på bakgrunn av tittel og sammendrag. 30 artikler ble gjennomlest i fulltekst og er inkludert. Artikkelen er også basert på forfatterens erfaring gjennom egen og andres forskning ved Senter for Klinisk Hjerteforskning, Hjertemedisinsk avdeling, Oslo universitetssykehus Ullevål.
Overvekt og fedme
Overvekt og fedme har over de siste tiårene blitt et stadig økende globalt problem og er assosiert med metabolske sykdommer som insulinresistens, diabetes type 2, aterosklerose, degenerative sykdommer og noen former for kreft (1). Overvekt defineres av verdens helseorganisasjon (WHO) som en kroppsmasseindeks (KMI) ≥ 25 kg/m2 og fedme ved en KMI ≥ 30 kg/m2.
Variasjoner i muskelmasse og fordelingen av fett på kroppen gjør at KMI på individnivå kan være problematisk, men er likevel en viktig indikator på helsetilstanden i større grupper. Fra å være et problem hovedsakelig i høyinntektsland er andelen med overvekt/ fedme økende også i lav- og mellominntektsland og i dag er det flere i verden som dør av sykdommer knyttet til overvekt/fedme enn av undervekt (1). I et evolusjonsperspektiv er de mekanismer som tidligere var viktige for å overleve sult og infeksjoner, med dagens kontinuerlige tilgang på mat kombinert med inaktivitet, kommet ut av balanse og resulterer i metabolske sykdommer.
Insulinresistens er en sentral mekanisme ved sykdommer knyttet til fedme (2). De viktigste funksjonene til insulin i fettvevet er å senke hastigheten på lipolysen, nedbrytningen av lipider til frie fettsyrer i fettcellene (adipocyttene) og å stimulere transport av glukose inn i adipocyttene (2). Et insulinresistent fettvev er mindre følsomt for insulin og dette reflekteres i høye nivåer av glyserol, frie fettsyrer (hyperlipidemi) og glukose (hyperglykemi) i sirkulasjonen. Når glukoseopptak i cellene reduseres, fører dette til at β-cellene i pankreas kompenserer ved å skille ut mer insulin. Insulinresistens vil derfor etter hvert føre til forhøyede konsentrasjoner av insulin i sirkulasjonen (3). Insulinresistens som forverres kan over tid hos disponerte individer føre til en utmattelse av β -cellene i pankreas og resultere i type 2 diabetes (2, 3). Overskudd av frie fettsyrer fører til dannelse av fosfolipider og kolesterol i leveren som deretter skilles ut i blodet.
Normalt fettvev
Hos mennesker består fettvevet hovedsakelig av hvitt fettvev, men i tillegg finnes det områder med brunt fettvev, spesielt hos nyfødte. Hovedoppgaven til det brune fettvevet er å produsere varme (termogenese).
Adipocyttene i det hvite fettvevet består av en kjerne som er lokalisert ut mot celleveggen og en stor lipiddråpe som utgjør opptil 90 % av cellen. Her lagres energioverskudd som blir tatt opp av fettcellen som triglyserider, såkalt lipogenese. Når kroppen har behov for energi frigjøres frie fettsyrer fra adipocyttene ved lipolyse og fraktes med sirkulasjonen som energi til muskler og annet vev.
I tillegg til adipocyttene består det hvite fettvevet av andre celler som fibroblaster (produserer ekstracellulær matrix og kollagen), endotelceller, nerveceller, makrofager og preadipocytter som enda ikke er fylt med lipider (5). Disse andre cellene utgjør opptil 50 % av fettvevets celler.
Makrofagene i et normalt/ikke-overvektig fettvev skiller ut anti-inflammatoriske cytokiner som f.eks. adiponektin, transforming growth factor beta (TGF-𝛽), interleukin (IL)-10, IL-4, IL-13, IL-1 receptor antagonist (IL-1Ra) og apelin (6). Av disse uttrykkes spesielt adiponektin i store mengder av differensierte adipocytter, og det er høye nivåer i sirkulasjonen. I tillegg til de anti-inflammatoriske egenskapene, er adiponektin et regulatorisk cytokin som også fremmer insulinfølsomheten i fettvevet. Nivået av adiponektin synker både ved insulinresistens og inflammatoriske tilstander, men øker igjen ved forbedret insulinfølsomhet, enten det er som følge av vektreduksjon eller medikamentell behandling (7).
Leptin er et eksempel på et signalmolekyl som kun produseres i adipocyttene, mens leptinreseptorer finnes både i sentralnervesystemet og i perifert vev. Genekspresjon og utskillelse av leptin reguleres av en rekke faktorer inkludert insulin og pro-inflammatoriske cytokiner som TNF-α and IL-1. Leptin er et hormon som sender signaler til hjernen om kroppens energistatus og regulerer appetitten. Et paradoks er at man hos sykelig overvektige ser høye nivåer av leptin, noe som har gitt opphav til en teori om leptinresistens ved fedme. I tillegg har leptin en rolle som cytokin med en sterkt pro-inflammatorisk aktivitet som bidrar til den lavgradige inflammasjonen som sees ved bl.a. insulinresistens, type 2 diabetes og aterosklerose (8) .
Lokalisasjon av fettvev
Fettvevet er fordelt på hele kroppen og det har vist seg at fettvevet har ulike funksjonelle egenskaper og utgjør ulik risiko for metabolske sykdommer ved overvekt og fedme avhengig av hvor på kroppen fettet befinner seg. Det er i tillegg vist at lokalisasjon er viktigere enn den totale massen når det kommer til risiko for metabolske sykdommer.
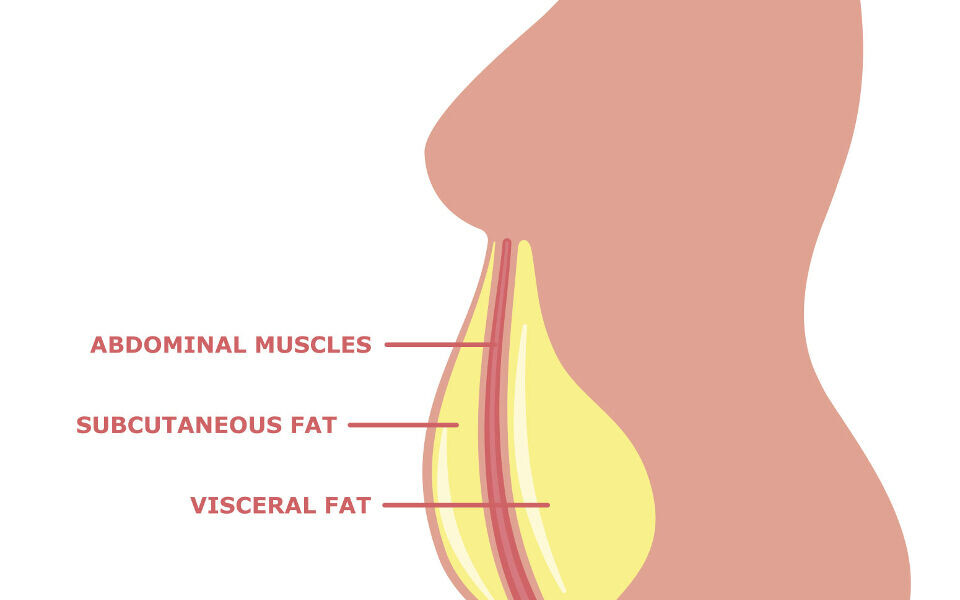
Det subkutane fettet (underhudsfettet) er det naturlige og største lagringsstedet for energioverskudd hvor frie fettsyrer og glyserol som triglyserider lagres i fettcellene, men det subkutane fettvevet har begrenset kapasitet til å utvide seg og rekruttere nye adipocytter. Grensen for når denne kapasiteten er nådd er individuell og sannsynligvis både genetisk bestemt i kombinasjon med modifikasjoner som følge av livsstilsfaktorer før pubertetsalderen (9). Når lagringskapasiteten til det subkutane fettvevet (figur 1) er overskredet, lagres fettet rundt indre organer, såkalt visceralt fett.
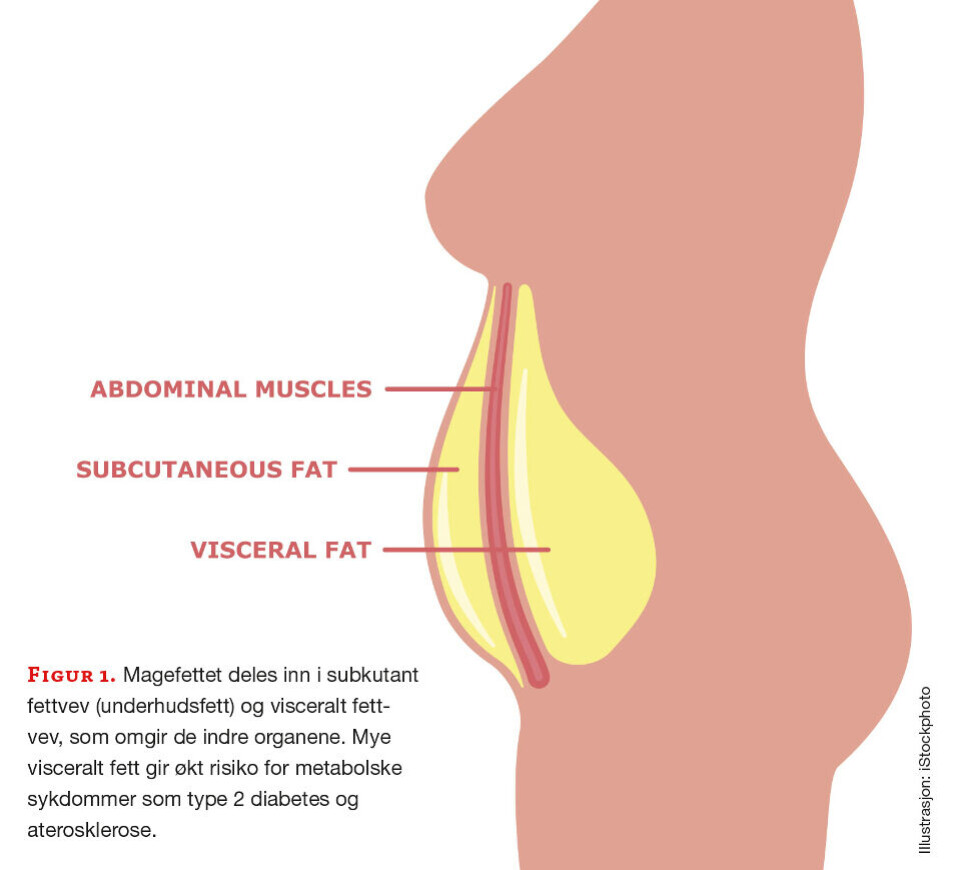
Visceralt fett gir høyere risiko for å utvikle metabolske sykdommer enn overskudd av fett i det gluteofemorale området, som er fettet på rompe, lår og hofter (2). Kvinner har en større evne til å lagre fett i det gluteofemorale området, mens overvektige menn har mer visceralt fett enn overvektige kvinner (10).
Midjemål er et lett tilgjengelig og mye brukt klinisk mål for å anslå risikoen for å utvikle sykdommer knyttet til overvekt og fedme. Magefettet (abdominalt fett) kan deles inn i det som ligger rett under huden, det subkutane fettet, og det som omgir organene i mageregionen, det viscerale fettet (figur 2). Det subkutane og det viscerale magefettet har ulike egenskaper (10). Det viscerale inneholder både flere inflammatoriske celler og immunceller, bl.a. makrofager, og produserer høyere nivåer av pro-inflammatoriske cytokiner, f.eks. tre ganger så mye IL-6 som det subkutane fettvevet (11). Det viscerale fettet har også større infiltrasjon av blodårer og nerver og er i direkte kontakt med portal-sirkulasjonen som fører blod til leveren (12). Det inneholder færre preadipocytter, slik at det dannes færre nye adipocytter, og de opprinnelige adipocyttene øker i størrelse, men mister mer av sin opprinnelige funksjon. Både insulinfølsomheten og evnen til å ta opp frie fettsyrer og triglyserider reduseres.
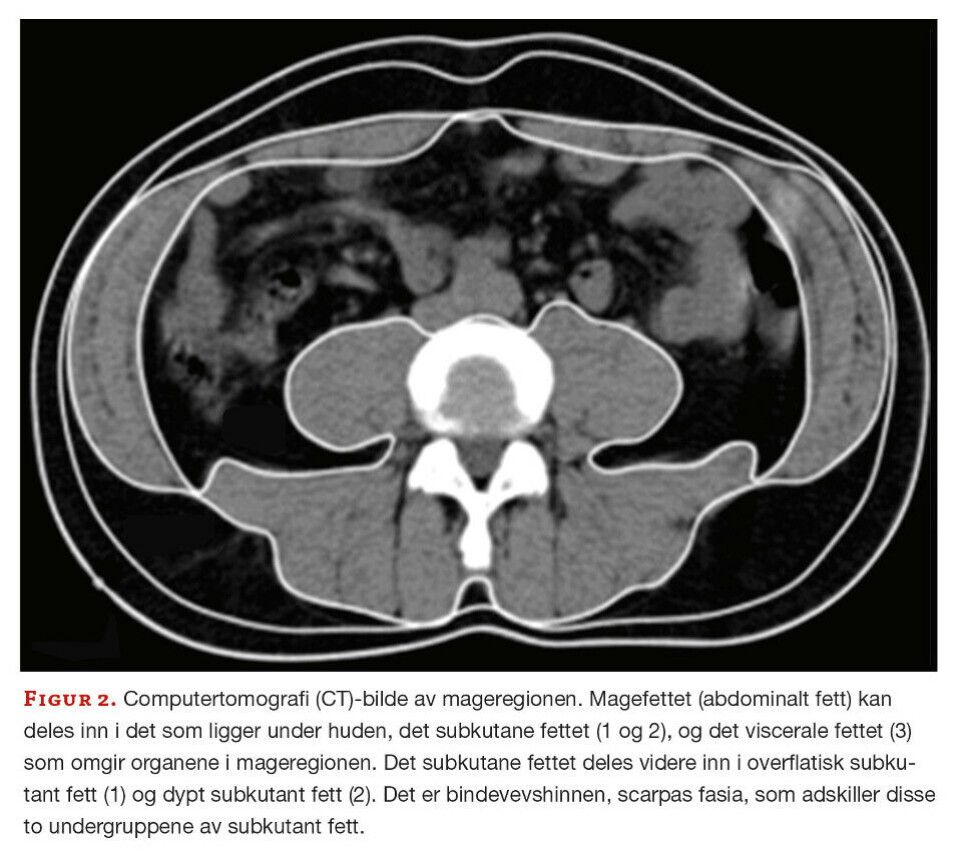
Det subkutane fettet deles videre inn etter scarpas fascia, en bindevevshinne, der det overflatiske subkutane fettet ligger over hinnen, ut mot huden, og det dype subkutane fettet ligger under hinnen, det vil si inn mot det viscerale fettet (figur 1). Det dyptliggende subkutane fettet ligner mer på det viscerale fettet, er mer ugunstig enn det overflatiske og er assosiert med høyere risiko for metabolske sykdommer. Det er imidlertid vist at det subkutane, som er enkelt å få tatt prøve av hos mennesker, kan være velegnet for å studere fettinflammasjon, da det i stor grad korrelerer til insulinresistens og total fettmengde (13).
Fettet rundt hjertet. Omtrent 80 % av hjertet er normalt dekket av fett som deles inn i epikardielt og perikardielt fettvev. Det epikardielle fettvevet ligger rett på hjertemuskelen (myokard) og deler mikrovaskulatur med årene som omkranser hjertet (koronararteriene). Dette fettvevet er både et lager for intravaskulære frie fettsyrer og en energikilde for hjertemuskelen. Det er imidlertid også et aktivt endokrint organ og cytokinene som skilles ut har pga. sin nærhet en direkte effekt på myokard. Det perikardielle fettvevet er adskilt fra hjertet av bindevev som omslutter hjertet (perikard) (14). Perikardielt fett finnes i både små og store arterier og vener, og har vist seg å ha stor betydning for den vaskulære likevekten og har også anti-kontraktile egenskaper. Det epi- og perikardielle fettvevet har, i tillegg til ulik anatomisk plassering, også ulike metabolske og fysiologiske egenskaper. Epikardielt fettvev består, foruten preadipocytter og adipocytter, også av stromale vaskulære celler, nerveceller, immunceller og monocytter. Økt tykkelse og inflammasjon i epikardielt fettvev er vist å ha sammenheng med progresjon av hjertesykdom hos sykelig overvektige. Det er også vist økt inflammatorisk aktivitet i det epikardielle hjertefettet, uavhengig av KMI (26). Dette fettet antas å være nokså likt det viscerale fettet i sine egenskaper (15). Det perikardielle fettvevet synes å ha mindre inflammatoriske egenskaper og effekter, men mye er fortsatt ukjent.
Inflammasjon i fettvevet
Ved for høyt kaloriinntak og inaktivitet over tid utvides fettvevet ved at det dannes nye adipocytter (hyperplasi) og spesielt ved at fettcellene blir større (hypertrofi) (16) . Hos barn utvides fettvevet i hovedsak ved dannelse av nye adipocytter, mens det kan tyde på at hypertrofi er hovedårsaken ved overvekt hos voksne (9). I et hypertrofisk fettvev aktiveres en rekke signalveier som induseres ved at cellene utsettes for stress fra bl.a. frie fettsyrer, oksygenmangel (hypoksi), endoplasmatisk retikulum (ER) stress og av frie oksygenradikaler (ROS).
Når fettvevet utvides utover sin kapasitet dør flere fettceller. Celledød medfører at immunceller, hvorav størstepartene er makrofager, tiltrekkes (17) (figur 3).

Disse endrer sin fenotype fra å være anti-inflammatoriske, M2-makrofager, til en pro-inflammatorisk fenotype, M1-makrofager. Mekanismene bak dette skiftet i fenotype er ikke fullt ut forstått, men det er vist at det finnes et spekter av ulike stadier og fenotyper blant de aktiverte pro-inflammatoriske makrofagene avhengig av type stimuli (6). De pro-inflammatoriske makrofagene i fettvevet samler seg rundt døde eller døende adipocytter og danner kronelignende strukturer som fagocyterer lipiddråper og cellerester og blir til store skumlignende celler (18) (figur 2). I tillegg til at makrofager tiltrekkes og endrer karakter, vil anti-inflammatoriske T-celler blir erstattet med pro-inflammatoriske T-celler som CD8+ og Th1 CD4+. Også B-celler, naturlige drepeceller (NK-celler), naturlige T-drepeceller (NKT-celler), eosinofile, nøytrofile og mastceller blir tiltrukket og infiltrert (6).
En slik infiltrasjon av inflammatoriske celler i fettvevet ved overvekt og fedme, skaper en kronisk inflammasjon i vevet. Ulike typer stimuli, som cellulær skade og oksidativt stress, fører til utskillelse av pro-inflammatoriske cytokiner, bl.a TNF-𝛼, IL-6, IL-1β og MCP-1. Flere av disse har i en rekke studier vist å føre til insulinresistens ved å hindre insulinsignaleringen direkte eller indirekte. Det skjer direkte ved å hindre tyrosin-fosforylering av substratet, insulin reseptor substrat (IRS), som insulinreseptoren er avhengig av for å formidle signalet fra insulin inn i cellen. Indirekte kan virkningen av insulin hemmes ved at pro-inflammatoriske kinaser som c-Jun N-terminal kinase (JNK), kappa Bkinase 𝛽 (IKK𝛽)/NF𝜅B og protein kinase C (PKC) aktiveres. Disse kinasene har alle vist seg å inhibere virkningen av insulin ved serin-fosforylering av insulin reseptor substrat-1 (19).
Da TNF-α ble funnet økt uttrykt i fettvevet hos overvektige mus på 1990-tallet var dette den første indikasjonen på en sammenheng mellom overvekt og økte nivåer av pro-inflammatoriske cytokiner i fettvevet (20). Det er senere vist at TNF-α er økt uttrykt i fettvevet også hos mennesker med overvekt og insulinresistens (21). TNF-α produseres av makrofagene, men også av adipocyttene selv og påvirker insulinresistensen i fettvevet både direkte og indirekte. TNF-α hemmer virkningen av insulin direkte ved å hindre insulinsignalering på insulinsubstratnivå, som tidligere nevnt, og indirekte ved å påvirke en rekke signalveier, gener og transkripsjonsfaktorer i fettvevet. Dette fører bl.a. til økt lipolyse, redusert opptak av frie fettsyrer, økt rekruttering av nye fettceller til fettvevet og redusert adiponektin-nivå (22). TNF-α spiller i tillegg en viktig rolle ved å indusere produksjonen av flere andre pro-inflammatoriske cytokiner bl.a. IL-6, IL-1β og MCP-1 (23).
IL-6 er sammen med TNF-α ett av de cytokinene det er forsket mest på. IL-6 har en rekke ulike roller bl.a. i immunforsvaret og i inflammatoriske prosesser og det ser ut til å være avhengig av vevstype og den metabolske tilstanden. Selv om leveren er hovedprodusent av IL-6, kommer ca. 1/3 av sirkulerende IL-6 fra fettvevet, hvor det produseres både av makrofager, lymfocytter og adipocytter (11). Det er vist at IL-6 er økt i både fettvevet og særlig i sirkulasjonen ved overvekt og insulinresistens (21).
MCP-1 er det første kjemokinet (dvs. det har kjemotaktiske egenskaper) som ble oppdaget, og det mest studerte. MCP-1 skilles ut som respons på bl.a. oksidativt stress og pro-inflammatoriske cytokiner og produseres i mange celletyper, men i hovedsak av makrofager, endotelceller og adipocytter (24). MCP-1 skilles ut fra fettvevet ved overvekt/fedme, rekrutterer sirkulerende monocytter til områder med inflammasjon og har vist seg å bidra direkte til insulinresistens i fettvevet (25). MCP-1-stimulerte adipocytter in vitro har vist seg både å senke insulin-stimulert glukoseopptak og redusere insulin-indusert fosforylering av insulin reseptor tyrosin. MCP-1 hemmer også adipocytt vekst og differensiering ved å hemme utrykket av en rekke gener for adipogenese.
IL-1β som er ett av cytokinene i IL-1 superfamilien, er et annet av de pro-inflammatoriske cytokinene som i en rekke studier er vist å være knyttet til insulinresistens. IL-1β er også involvert i ateroskleroseprosessen og det har vært vist en gunstig effekt på hjerte-karsykdom av behandling med IL-1β antagonist. IL-1β aktiveres og slippes ut i sirkulasjonen først etter å ha blitt spaltet av fra pro-IL-1β inne i cellen. Denne spaltingen skjer når NLR family pyrin domain containing-3 (NLRP3)-inflammasomet aktiveres. NLRP3-inflammasomet er et multiproteinkompleks som befinner seg i cytosol i bl.a. adipocytter og myeolide celler og som aktiveres av både endogene og eksogene faresignaler. Studier har vist at også fedme fører til en slik aktivering av inflammasomet, som igjen fører til IL-1β mediert inflammasjon og insulinresistens. Det er også blitt vist at mus som mangler NLRP3 har en forbedret effekt av insulin (26). Det er usikkerhet rundt hva ved fedme som fører til aktiveringen av inflammasomet, men ceramider, en familie av lipider involvert i en rekke fysiologiske funksjoner, bl.a. celledød, og økt ROS-produksjon er blitt diskutert (26). NLRP3-inflammasomet aktiverer også det pro-inflammatoriske cytokinet IL-18 på samme måte.
Ved Senter for Klinisk hjerteforskning observerte vi tidlig en sammenheng mellom glukose og IL-18 (27) og har senere studert IL-18 og dens sammenheng med insulinresistens, type 2 diabetes og overvekt i flere studier. Vi har bl.a. også vist at hos friske med lett grad av overvekt var det en sterk sammenheng mellom grad av insulinresistens, KMI, fettmengde (subkutant og visceralt) og IL-18 nivå i sirkulasjonen og det genetiske uttrykk av både IL-18 og NLRP3 i fettvev (13). Derimot hos type 2 diabetikere kunne vi ikke vise disse samme sammenhenger, sannsynligvis pga. den medikamentelle behandlingen og annen underliggende sykdom hos disse (28).
Diskusjon
Tidligere ble fedme primært sett på som et kosmetisk problem forårsaket av usunne matvaner og fysisk inaktivitet. I dag er fedme i større grad ansett som en sykdom med komplekse årsaker, som i tillegg til matvaner og inaktivitet er avhengig av miljø og genetikk, og er - som omtalt her - sterkt knyttet til insulinresistens og inflammasjon. Flere genetiske studier har vist at overvekt er arvelig (29). Dette gjør overvekt til et komplekst problem, både på individnivå og globalt, og med de metabolske sykdommer som knyttes til overvekt og fedme får det også store sosioøkonomiske kostnader. Økt fysisk aktivitet er som kjent et viktig grep for å motvirke sykelig overvekt.
En rekke studier har vist at overvektige med god fysisk form har lavere risiko for å få metabolske sykdommer, sammenliknet med inaktive normalvektige (30). Sammen med fysisk aktivitet er kostholdsendringer ofte det første tiltaket som settes inn for å redusere vekten. Men et varig vekttap kan motvirkes bl.a. av kroppens nedarvede mekanismer for å unngå sult, som f.eks. fører til nedsatt forbrenning og økt appetitt og er derfor ofte vanskelig å opprettholde. Det er derfor i noen tilfeller behov for alternative behandlingsformer for å bekjempe metabolske sykdommer som følge av overvekt.
Flere ulike strategier er forsøkt for å begrense det pro-inflammatoriske miljøet og dermed forbedre insulinfølsomheten og hindre type 2 diabetes hos overvektige pasienter. Potensielle mål kan være immunceller, cytokiner, adipokiner eller kjemokiner. Behandling med TNF-α inhibitor er vist å redusere fastende glukose og øke nivået av sirkulerende adiponektin hos pasienter med overvekt og metabolsk syndrom (31). Blokkering av IL-6 er godkjent som behandling for betennelsessykdommer som leddgikt (revmatoid artritt) og barneleddgikt (revmatoid ideopatisk artritt), samt den sjeldne sykdommen lymfeknute hyperplasi (Castleman sykdom). Studier viser at blokkering av IL-6 ser ut til å kunne ha en gunstig effekt også på sykdomstilstander som type 2 diabetes og aterosklerose (32).
Selv om det er gjort mye forskning for å forstå mekanismene bak inflammasjon og insulinresistens generelt og i fettvev, er det fortsatt mye som er ukjent. Videre forskning og metodologisk utvikling gir muligheter for bedre og mer målrettede behandlingsstrategier for den stadig økende byrden av metabolske sykdommer som er knyttet opp mot overvekt og fedme.
Takk
Takk til professor dr. philos Ingebjørg Seljeflot for gjennomlesning og korrektur av artikkelen og til min datter Linnea Åkra Palma som har tegnet figur 3.




























