FAG Originalartikkel
Deteksjon av kromosomavvik i formalinfiksert og parafininnstøpt autopsimateriale fra fostre ved hjelp av FISH
Deteksjon av kromosomavvik i formalinfiksert.pdf(82 KB)
Innledning
Ved over halvparten av spontanaborter foreligger det en alvorlig kromosomfeil, mens dette er tilfelle ved kun fem prosent av dødfødte. Dette betyr at de fleste befruktninger med kromosomfeil tapes i løpet av svangerskapet (1). De fleste numeriske kromosomavvik hos fostre er assosiert med strukturelle utviklingsavvik (2). I de tilfeller der en ved obduksjon av et foster får mistanke om kromosomfeil, er dette viktig å verifisere. Det er mindre risiko for gjentakelse av utviklingsavvik dersom de skyldes en kromosomfeil, dette har derfor stor betydning ved genetisk veiledning av foreldre.
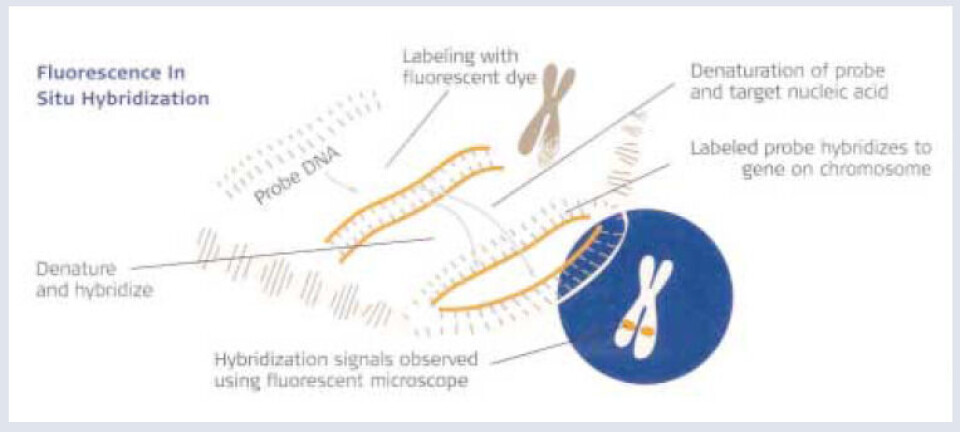
Trisomi 13, 18, 21 eller numerisk avvik i X og Y kromosomet utgjør til sammen 60 - 70 prosent av alle numeriske kromosomavvik som forårsaker spontanabort eller intrauterine dødsfall (3). Fluorescerende in situ hybridisering (FISH) er en teknikk som anvendes som supplement til karyotyping ved prenatal fostervannsdiagnostikk for å detektere de vanligste aneuploidiene (trisomier, monosomier og polyploidier). Det er en sensitiv metode for deteksjon av antall kromosomkopier i interfase-kjerner (3,4,5) ved at fluorescensmerkete kromosomspesifikke prober hybridiseres til komplementære DNA-sekvenser. Produktet visualiseres i et fluorescensmikroskop. I sjeldne tilfeller er formalinfiksert og parafininnstøpt vev (parafinblokker) fra fosterobduksjoner det eneste tilgjengelige materiale for å detektere mistenkt aneuploidi. Interfase FISH kan da utføres ved å isolere hele cellekjerner fra parafinblokker. Kjernene må i slike tilfeller alltid forbehandles (permeabiliseres) før hybridiseringen med prober (4).
Hybridiseringsbetingelsene for FISH på obduksjonsmateriale som er formalinfiksert og parafininnstøpt, er mindre optimale enn ved bruk av biopsimateriale eller ferskt vev (3,5). Siden det kan ta lang tid fra fosterdød til obduksjon, vil materialet ha ulik grad av autolyse og DNA degradering. I tillegg medfører lang oppbevaringstid på formalin ytterligere fragmentering og depurinering (basetap) av DNA. Optimal forbehandling av kjernepreparatene er helt nødvendig for vellykket hybridisering og på grunn av varierende forhold behøves ofte separate justeringer for hvert enkelt kasus (6). Det finnes få publikasjoner som omhandler FISH på parafininnstøpt obduksjonsmateriale, og tidligere forbehandlingsmetoder beskriver repeterte enzymbehandlinger av cellekjernene før hybridisering (3,4,5). Andre har vist at forbehandling med en kombinasjon av varm glyserol og/eller buffer, i tillegg til enzymbehandling, er gunstig (5,6,7). En svensk studie har vist at det er ekstra viktig å benytte kombinert forbehandling dersom preparatet er fra autopsimateriale (5). Vår erfaring med FISH som beskrevet av Kopf et al (4) før den nye forbehandlingen ble tatt i bruk, var på autopsimateriale kun vellykket med sentromerprober (CEP) (3). Det ble ofte nødvendig med individuell behandling i form av repeterte enzymbehandlinger og rehybridiseringer. Med lokusspesifikke (LSI) prober ble FISH som regel mislykket.
Det er så vidt vi vet ingen andre patologilaboratorier i Norge som utfører FISH på materiale fra fosterobduksjoner. Vi presenterer her resultater der vi har optimalisert den metoden vi etablerte i 1997 (3,4) ved å benytte en mer effektiv forbehandling av ekstraherte hele kjerner fra parafinblokker med et nyere, kommersielt tilgjengelig kit.
Materiale og metode
Materialet er fra fostre med utviklingsavvik og mistanke om numerisk kromosomfeil, men der det ikke tidligere er utført karyotyping på grunn av uventet spontanabort eller intrauterin fosterdød. Det er benyttet formalinfiksert og parafininnstøpt vev fra ti obduksjoner i tidsperioden 2004-2008. Det ble rekvirert FISH med tanke på de vanligste aneuploidiene og materialet ble hybridisert med fluorescensmerkete CEP-prober spesifikke for kromosom 18, X og Y, og LSI-prober spesifikke for kromosom 13 og 21.
Undersøkelse av kromosom 18 ble rekvirert for samtlige ti kasus, X og Y kromosomundersøkelse for sju kasus og kromosom 21 og 13 for åtte kasus hver. Histologiske hematoxylin-erytrosin-safran (HES) fargede snitt fra parafinblokker fra sju kasus ble evaluert i lysmikroskop med hensyn på vevsautolyse. Vevets autolysegrad varierte fra lett (+), moderat (++) til uttalt (+++) (3). For tre kasus var autolysegrad ukjent. I de fleste tilfellene var thymus det organet med størst celletetthet som var best bevart og ble derfor brukt til FISH. Placenta og nyre ble valgt i noen kasus.
Isolering av hele kjerner fra parafinblokk:
Snitting, deparafinering og isolering av hele kjerner fra parafinblokk ble utført som beskrevet hos Kopf et al (4). Det ble benyttet 100-200 ul suspensjon av isolerte kjerner i 0,1 x SSC (Abbott Molecular Inc) ved tillaging av kjernepreparater på Superfrost® Pluss objektglass med Shandon Cytospin® 4 Cytocentrifuge. Kvalitetskrav til kjernepreparat beskrevet av probeleverandør Vysis (Abbott Molecular Inc) med hensyn på morfologi og antall ble fulgt.
Ny forbehandlingsmetode:
Kjernepreparat ble forbehandlet som beskrevet i manualen og med reagenser fra Histology FISH Accessory Kit, K5599 (Dako, Glostrup, Danmark). Kort beskrevet ble det først inkubert i 10 minutter i Vial 1 fra kit (Pre-treatment Solution) oppvarmet til kokepunktet, og deretter enzymbehandlet med Vial 2 fra kit (Pepsin) ved romtemperatur i fem minutter.
Co-denaturering og hybridisering:
Temperatur og tid for alle prober var som beskrevet av Kopf et al (4) og det ble anvendt Dako Hybridizer (Dako, Glostrup, Danmark). Hybridisering ble utført med følgende fluorescensemerkete DNA-prober fra Vysis, Abbott Molecular Inc:
Kromosom 13 spesifikk probe LSI®13 (13q14) Spectrum Green™ DNA Probe, kat. no 30-192018. Proben er locusspesifikk og består av et sett med overlappende kloner som dekker RB1-genet som er 180 kb, og i tillegg dekker proben 110-170 kb i 5’-retning og 120 kb i 3’ retning for genet.
Kromosom 21 spesifikk probe LSI 21® 21 Spectrum Orange™ DNA Probe, kat. no 30-190002. Proben er locusspesifikk og inneholder DNA-sekvenser komplementære til loci D21S259, D21S341 og D21S34 (21q22.13-q22.2).
Kromosom 18 spesifikk probe CEP 18 (D18Z1) Spectrum Green™ DNA Probe, kat. no 32-112018. Proben er sentromerspesifikk, består av Alpha Satellite DNA og hybridiserer til repeterte satellitt DNA-sekvenser lokalisert nær sentromeren i kromosom 18, 18p11.1-q11.1
Kromosom X og Y spesifikke prober CEPX (DX21) Spectrum Green/Y (DYZ3) Spectrum Orange Alpha Satellite DNA Probe, kat. no 32-111054. Proben er sentromerspesifikk, består av Alpha Satellite DNA og hybridiserer til repeterte satellitt DNA-sekvenser lokalisert nær sentromeren i kromosom X, xp11.1-q11.1 og i kromosom Y, yp11.1-q11.1.
Posthybridiseringsvask av preparat:
2 x SSC (Abbott Molecular Inc) pH 7,0 i tre minutter ved romtemperatur med påfølgende kontrastfarging av kjerner med DAPI fra Histology FISH Accessory Kit.
Deteksjon av hybridiseringsresultat for de spesifikke kromosomer:
Fluorescensesignaler i 200 enkeltliggende kjerner i hvert preparat ble telt på 600X forstørrelse i Nikon Eclipse 90i fluorescensmikroskop med exitasjonsfilter for FITC (for prober merket med Spectrum Green), TRITC (for prober merket med Spectrum Orange) og DAPI (for blå kontrast i kjernene). Vysis retningslinjer for signaltelling ble fulgt. Minimum 70 prosent av kjernene måtte være entydige for å stille en sikker diagnose, det vil si 70 prosent av kjernene måtte ha to signal for å være disomi, tre signal for å være trisomi eller ett signal for å være monosomi (3).
Resultater
Numerisk kromosomavvik ble detektert i fire av ti kasus. I to tilfeller forelå det trisomi 21 (Down syndrom), i ett tilfelle trisomi 18 (Edward syndrom) og hos et pikefoster forelå det monosomi X (Turner syndrom). I de resterende seks kasus ble det ikke detektert avvik for noen av de undersøkte kromosomer.
Tabell 1 viser FISH-resultater for ti kasus med til sammen 35 hybridiseringer der alle kjernepreparatene ble forbehandlet med Histology FISH Accessory Kit. 32 (91,4 prosent) av hybridiseringene var vellykket, tre (8,6 prosent) var mislykket. Deteksjon av antall kopier av kromosom 18, X og Y med CEP18 og CEP XY (sentromerspesifikke prober) var vellykket for alle utførte hybridiseringer. Ved mikroskopering var det tydelige fluorescenssignaler i enkeltliggende hele kjerner. Ett preparat viste ikke tilfredsstillende fluorescenssignaler for CEP 18-probe etter første forsøk, men ble vellykket etter ekstra pepsinbehandling og rehybridisering. Ni preparater viste to signaler for CEP 18-probe i hver opptelte kjerne, det vil si normalt antall kromosom 18, mens ett preparat viste tre signaler, det vil si tre kromosom 18 som er forenlig med trisomi 18 (figur 1). Hybridisering med CEP X og Y probe mot X og Y kromosom ble utført på sju kasus. Her viste seks preparat normale kjønnskromosomer med henholdsvis fire preparat med XX (piker) og to med XY (gutter). Ett preparat (en pike) hadde monosomi X ved opptelling, forenlig med Turner syndrom (figur 2).
Deteksjon av antall kopier av kromosom 13 og 21 med LSI 13 og LSI 21 (lokusspesifikke prober) var også mulig for de fleste utførte hybridiseringer. Ved mikroskopering var signalene i enkeltliggende hele kjerner tydelige, men noe mindre og svakere enn signalene for sentromerprober.
Av åtte hybridiseringer med LSI 13 var sju vellykkede og en mislykket. Alle preparatene med vellykkede hybridiseringer for kromosom 13 viste to signaler i hver opptelte kjerne, det vil si normalt antall (figur 3). Det mislykkede preparatet ble pepsinbehandlet fem minutter ekstra (totalt 10 minutter) og rehybridisert, men hybridisering lyktes ikke. For hybridisering med LSI 21 ble åtte preparater vellykkede, seks av dem viste normalt antall signaler, mens to viste tre signaler, forenelig med trisomi 21 (figur 4). To preparater ble mislykkede selv etter ekstra pepsinbehandling.
Diskusjon
FISH på preparat fra formalinfiksert og parafininnstøpt materiale gir mulighet for genetisk informasjon når karyotype ikke er tilgjengelig (3,8). FISH med kromosomspesifikke prober gir mulighet til presis informasjon om antall kromosomkopier, men probenes spesifisitet innebærer at de kun hybridiseres til komplementær DNA-sekvens. Dette begrenser analysen idet den ikke gir informasjon om andre loci enn de som probene er spesifikke for. I vårt materiale har vellykket FISH med bruk av spesifikke prober påvist kromosomavvik i fire av ti kasus. I de kasus der hybridiseringsresultatene er vellykket og viser normalt antall kopier for de undersøkte kromosomene, kan det likevel ikke utelukkes andre kromosomavvik. For ett kasus er hybridisering vellykket med CEP 18 og CEP XY som viser normalt antall kromosomkopier, men fordi hybridisering med LSI 13 og LSI 21 er mislykket, kan ikke trisomi 13 eller trisomi 21 utelukkes.
FISH kan utføres både på parafinsnitt, på isolerte kjerner eller på tissue microarray (TMA). Deteksjon av numeriske avvik er en kvantitativ analyse og preparater med isolerte kjerner er derfor best egnet og ble brukt i denne analysen. Det er betraktelig enklere å evaluere og telle signaler i et preparat som består av hele enkeltliggende kjerner enn i et parafinsnitt der mange celler overlapper hverandre og der kjerner kan være delte på grunn av snittingen. Det er vist at opp til 10 - 30 prosent av kjernene har mistet ett eller begge signal der det skal være to (5). Dette kan gjøre analyser med spørsmål om numeriske kromosomavvik usikre, da det kreves at minimum 70 prosent av kjernene må være entydige for å stille riktig diagnose (3).
De ti kasus som er presentert her, er fra ulike patologilaboratorier med egne protokoller for behandling av obduksjonsmateriale til formalinfiksering og parafininnstøpning. Autolysegrad varierer med tiden som er gått fra fosterdød til formalinfiksering, og oppbevaringstid på formalin varierer. Disse to variablene representerer den største hindringen for vellykket analyse. Det er kjent at det er vanskeligere å lykkes med FISH på første forsøk på materiale fra parafinblokker enn hvis man har ferskt vev (5). Deteksjon av spesifikke kromosomer med FISH forutsetter at mål-DNA sekvensen i materialet til analyse er tilstrekkelig intakt for hybridisering med komplementær probe. DNA i obduksjonsmateriale viser ulik grad av fragmentering og depurinering på grunn av autolyse og lang oppbevaringstid på formalin (6). Hvis mål-DNA er for ødelagt til at den spesifikke proben kan hybridiseres til sekvensen, kan FISH umulig lykkes uansett forbehandlingsmetode. Sannsynligvis er dette tilfelle for preparatene fra kasus 3 og 6 der hybridisering med LSI 13 og LSI 21 var mislykket. Uttalt autolyse i disse tilfellene hadde sannsynligvis innvirkning på resultatet, likevel lyktes hybridiseringer med CEP 18 og CEP XY. At hybridisering lyktes med sentromerprobene, men ikke med de lokusspesifikke probene, skyldes muligens at repeterte alphasatellitt DNA-sekvenser lokalisert nær sentromeren sannsynligvis er bedre bevarte enn sekvenser komplementære til de lokusspesifikke probene.
Formalinfiksering danner kryssbindinger mellom proteinmolekyler i kjernen og mellom proteiner og DNA. Kryssbindingene hindrer proben i å penetrere inn i kjernen og hybridiseres til mål-DNA (6).
Optimal forbehandling med Histology FISH Accessory Kit er oppnådd med 32 vellykkede av totalt 35 hybridiseringer. Forbehandlingen har resultert i preparater med tilgjengelig mål-DNA sekvens. Mest sannsynlig bryter den varme bufferen som finnes i Histology FISH Accessory Kit opp formalinkryssbindingene mer effektivt enn tidligere metoder. Enzymbehandling av preparatene fjerner avfallsstoffer fra autolyse og rydder vei slik at proben lettere kan penetrere og hybridisere til mål-DNA. Preparat fra kasus 3 hybridisert med LSI 13 og LSI 21 var mislykket, selv med ekstra enzymbehandlinger og rehybridisering. På kasus 6 lyktes heller ikke rehybridisering med LSI 21 etter ekstra enzymbehandling av preparat. Sannsynligvis skyldes dette autolyse.
Posthybridiseringsvask av preparater med autolyse og fragmentert DNA bør være skånsom for å unngå å vaske vekk spesifikke hybridiseringer, det vil si lav stringens i 2XSSC i romtemperatur. Imidlertid var det nødvendig å vaske mer med høyere stringens pga uspesifikke signal i preparater på kasus 2, 5 og 6, (0,4x SSC ved 65 °C i to minutter ble benyttet).
Konklusjon
Ny forbehandlingsmetode med bruk av Histology FISH Accessory Kit har forenklet deteksjonen av antall kromosomer i obduksjonsmateriale som er formalinfiksert og parafininnstøpt. Forbedring av det viktige forbehandlingstrinnet ved FISH gjør at færre preparater trenger individuell behandling før hybridisering med spesifikke prober.
Analysen bidrar til kartlegging og statistikk av numeriske kromosomanomalier og foreldre kan forsikres om at det er lav gjentagelsesrisiko ved senere graviditet.































