Originalartikkel
Nøytrofile granulocytter fra Sysmex XN – kan vi stole på svaret når flagget «Blasts/Abn Lympho?» rapporteres?
1. Fakultet for helsevitenskap, Institutt for naturvitenskaplige helsefag, Bioingeniørutdanningen, OsloMet - storbyuniversitetet
Innledning
«Gjør kloke valg» er en kampanje som oppfordrer helsearbeidere til å redusere bruken av undersøkelser som ikke tydelig er til fordel for pasientene (1). Bioingeniørmangel, økende bruk av laboratorieundersøkelser, samt oppfordringen om å begrense unødvendige undersøkelser utfordrer oss bioingeniører til å jobbe smartere. Vi er opplært til å sørge for kvalitet, og vi gjør gjerne tilleggsundersøkelser for å sikre best mulig kvalitet på prøveresultatene vi skal gi ut. Men tjener merarbeidet alltid hensikten? Vil det føre til bedre og raskere behandling av pasienten? Eller er det bare en tidstyv, som forsinker svarutgivelsen?
Flere organisasjoner anbefaler å undersøke blodutstryk når konsentrasjonen av nøytrofile granulocytter fra hematologiinstrumentene er mindre enn 1,0 x 109/L eller større enn 20,0 x 109/L (2, 3). En slik ekstra kontroll er tidkrevende og basert på vår erfaring kan den også være unødvendig.
Nøytrofile granulocytter analyseres på bred indikasjon. Økt antall (nøytrofili) ses blant annet ved bakterielle infeksjoner, myelogene leukemier og fysisk anstrengelse. Lavt antall (nøytropeni) ses ved sepsis, ondartete prosesser i beinmargen og behandling med cellegift (kjemoterapi). Ved alvorlig nøytropeni (nøytrofile granulocytter mindre enn 0,5 x 109/L) ses økt risiko for alvorlige bakterielle infeksjoner (4).
Ifølge resultatrapportene fra hematologiutsendelsene fra Norsk kvalitetsforbedring av laboratorieundersøkelser (NOKLUS) bruker de fleste laboratorier i Norge Sysmex XN-instrumenter til differensialtelling av leukocytter. I Sysmex XN-instrumentene blir leukocyttene merket med polymethine og analysert med fluorescens flowcytometri. Klassifiseringen av cellene baseres på lysspredningsdata, fluorescensdata og gitte algoritmer i programvaren. Konsentrasjon av nøytrofile granulocytter som rapporteres, inkluderer standardmessig umodne granulocytter (IG). Dersom helningen, distribusjonen og posisjonen til dataklyngen som representerer nøytrofile granulocytter i scattergrammet avviker fra det typiske mønsteret, vil flagget «WBC Abn Scattergram» bli rapportert (5). Unormale celler, slik som blaster og avvikende lymfocytter blir ikke målt kvantitativt, men rapporteres kvalitativt ved flagget «Blasts/Abn Lympho?» (6). Ved rapportering av flaggene «Blasts/Abn Lympho?» og «WBC Abn Scattergram», vil det kvantitative resultatet for nøytrofile granulocytter være merket med en stjerne (*) som indikerer at målingen er usikker (5). I slike tilfeller anbefaler både instrumentleverandøren og nasjonale og internasjonale retningslinjer at blodutstryk undersøkes for mulig forekomst av unormale celler. I tilfeller der unormale celler oppdages bør resultatene kvalitetssikres ved differensialtelling i blodutstryk (2, 3, 5, 7-9). Differensialtelling og morfologiske vurderinger av celler i blodutstryk kan gjøres manuelt i et lysmikroskop eller digitalt ved hjelp av bildegjenkjenningssystemer som CellaVision DM96 (10). Differensialtelling med immunfenotyping og fluorescens flowcytometri anses å ha betydelig høyere analytisk kvalitet enn differensialtelling i blodutstryk (11). Til tross for dette er manuell differensialtelling av 400 leukocytter fremdeles referansemetode for differensialtelling av leukocytter (12).
Hovedhensikten med denne studien var å undersøke om nøytrofile granulocytter kan rapporteres fra Sysmex XN uten å vurdere blodutstryk når prøvene er assosiert med flagget «Blasts/Abn Lympho?». I tillegg ble det undersøkt om flagget «WBC Abn Scattergram» kan gi nyttig informasjon med hensyn på å identifisere prøver der det er formålstjenlig å analysere nøytrofile granulocytter med en alternativ metode. For å vurdere dette ble nøyaktigheten til målingene fra Sysmex XN, CellaVision DM96 og manuell mikroskopi undersøkt ved å sammenligne med målinger fra flowcytometrisk immunfenotyping (IFCM).
Materiale og metode
Blodprøvene i studien var rutineprøver, tatt av voksne pasienter innlagt ved Akershus universitetssykehus (Ahus) i perioden november 2016 til juni 2017. Utvalget var rekruttert fra den generelle sykehuspopulasjonen. Prøvene var tappet på rør tilsatt K2EDTA (Greiner Bio One, Frickenhausen, Germany) og differensialtelling av leukocytter ble analysert på Sysmex XE-5000 (Sysmex Corporation, Kobe, Japan) ved Avdeling for tverrfaglig laboratoriemedisin og medisinsk biokjemi, Ahus. Totalt 240 prøver ble tilfeldig utvalgt basert på tilstedeværelse av ett eller flere leukocyttflagg, som tidligere beskrevet av Eilertsen et al. (13). Leukocyttflaggene inkluderte «Blasts?”, “ImmGran?”, “AbnLy/L‐blast?” og/eller “Atypical Lymph?”. Prøvene ble videre analysert på flowcytometeret Cytomics FC 500 med antistoffpanelet CytoDiff og CytoDiff CXP, programvareversjon 2.0 (Beckman Coulter, Miami, FL, USA) ved Ahus, som tidligere beskrevet (13). Etter analysering på Ahus, ble prøvene sendt til Fürst Medisinsk Laboratorium for differensialtelling på Sysmex XN-9000 (Sysmex Corporation), programvareversjon 00-18. Alle prøvene ble analysert på samtlige tre instrumenttyper innen seks timer etter prøvetaking. Av de 240 prøvene som viste et eller flere leukocyttflagg på Sysmex XE-5000, ble 208 prøver rapportert med flagget «Blasts/Abn Lympho?» på Sysmex XN-9000, og disse ble inkludert i studien. Terskelverdien (Q-verdien) for rapportering av «Blasts/Abn Lympho?»-flagget var satt til 100 etter leverandørens anbefalinger. To blodutstryk fra hver prøve ble preparert og farget med May Grünwald Giemsa rett etter prøvetaking i utstryks- og fargemaskinen SP-1000 (Sysmex Corporation). Alle blodutstryk ble analysert med CellaVision DM96 (Sysmex Corporation) og ved manuell lysmikroskopi på Ahus. Manuell lysmikroskopi ble utført ved at to bioingeniører hver talte og vurderte 100 leukocytter i separate blodutstryk. I CellaVision DM96 ble totalt 120 leukocytter per utstryk forhåndsklassifisert. Forhåndsklassifiseringen ble deretter vurdert av to bioingeniører, som vurderte hvert sitt parallelle utstryk. Leukocytter som var feilklassifisert ble omklassifisert til riktig kategori. Konsentrasjonen av nøytrofile granulocytter inkluderte både modne (segment- og stavkjernede celler) og umodne (metamyelo-, myelo- og promyelocytter) celler og ble for alle metodene målt som absoluttverdi (x109/L). Alle prøvene ble anonymisert og studien er godkjent av personvernombudet ved Ahus.
Statistikk
Statistiske analyser ble utført i SPSS versjon 28 (SPSS, Chicago, IL) og Diagnostic test evaluation calculator, versjon 22.021 (MedCalc, Ostend, Belgia). Resultatene for nøytrofile granulocytter (x 109/L) ble oppsummert som gjennomsnitt, median og laveste og høyeste målte verdi. Pearson korrelasjonskoeffisient ble benyttet for korrelasjonsanalyser og ordinær lineær regresjonsanalyse (OLR) ble brukt til å estimere sammenheng mellom resultatene fra IFCM-metoden og resultatene fra henholdsvis Sysmex XN, CellaVision DM96 og manuell mikroskopi av blodutstryk. Bland-Altman analyse med 95 %-grenser for samsvar (LoA) ble brukt til å vurdere overensstemmelse mellom resultatene fra IFCM-metoden og resultatene fra henholdsvis Sysmex XN, CellaVision DM96 og manuell mikroskopi av blodutstryk. Alle konfidensintervaller ble beregnet som 95 % konfidensintervaller (95 % KI). Data om biologisk variasjon ble brukt til å vurdere klinisk nytteverdi og ble hentet fra databasen til European Federation of Clinical Chemistry and Laboratory Medicine (14). Kvalitetsnivået «ønskelig» ble brukt som mål for tillatt systematisk feil og tillatt upresisjon, og tillatt totalfeil for analysen ble beregnet til ±18,7 %. Absolutt og relativ differanse mellom nøytrofile granulocyttresultatene fra IFCM-metoden og resultatene fra henholdsvis Sysmex XN, CellaVision DM96 og manuell mikroskopi av blodutstryk ble beregnet. Konsentrasjonsområdene <0,50 x 109/L, 0,50 – 0,99 x 109/L og 1,00 – 100,00 x 109/L ble benyttet for å vurdere nøyaktigheten til metodene ved konsentrasjonsnivåer som dekker alvorlig nøytropeni (15), anbefalingen gitt av NOKLUS (2), samt referanseverdier og nøytrofili. Variabelen «relativ differanse» ble omkodet til en dikotom variabel med verdiene «relativ differanse ligger innenfor grensen for tillatt totalfeil» og «relativ differanse ligger utenfor grensen for tillatt totalfeil». Flagget «WBC Abn Scattergram» ble omkodet til en dikotom variabel med verdiene «flagget er rapportert» og «flagget er ikke rapportert». Kjikvadrattest ble benyttet for å se på sammenheng mellom de to dikotome variablene «relativ differanse» og «WBC Abn Scattergram». Flaggets sensitivitet og spesifisitet ble beregnet i henhold til Galen og Gambino’s metode (16). Dersom «WBC Abn Scattergram» ble rapportert på prøver med relativ differanse mindre enn tillatt totalfeil, ble det kategorisert som et falskt positivt funn. Omvendt, dersom flagget ikke ble rapportert på prøver med en relativ differanse større enn tillatt totalfeil, ble det kategorisert som et falskt negativt funn.
Resultater
Konsentrasjonen av nøytrofile granulocytter i de 208 prøvene analysert med IFCM og CytoDiff-panelet varierte fra 0,02 x 109/L til 86,29 x 109/L med median verdi lik 3,67 x 109/L og gjennomsnittsverdi lik 8,08 x 109/L. For Sysmex XN og blodutstryksmetodene er tilsvarende data vist i tabell 1.
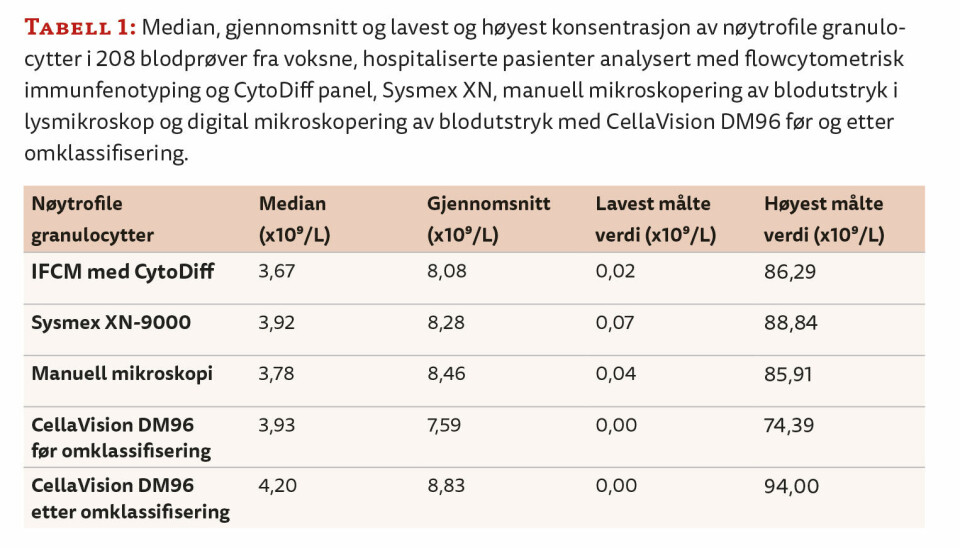
Korrelasjonsanalysen viste sterk lineær sammenheng mellom konsentrasjonen av nøytrofile granulocytter målt med IFCM-metoden og målingene fra henholdsvis Sysmex XN, CellaVision DM96 og manuell mikroskopi av blodutstryk. Korrelasjonskoeffisienten varierte mellom 0,984 (CellaVision DM96 før omklassifisering av celler mot IFCM) og 0,998 (Sysmex XN mot IFCM) (tabell 2).
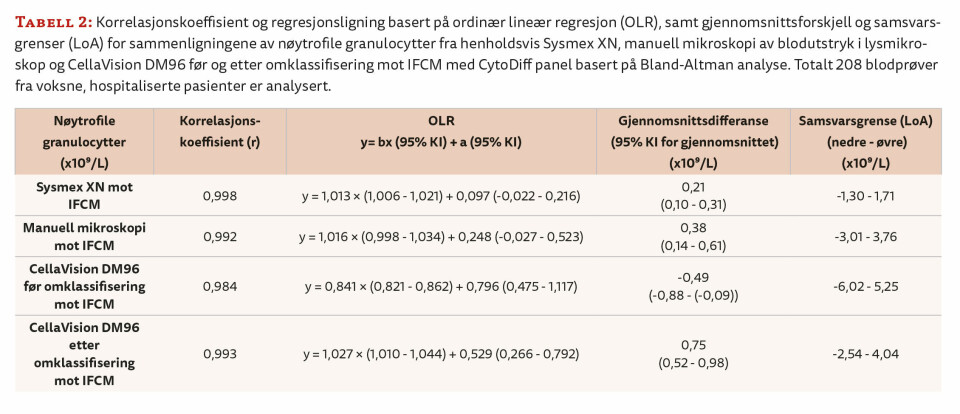
Regresjonsanalysen viste at Sysmex XN, CellaVision DM96 etter omklassifisering av cellene og manuell mikroskopi av blodutstryk i gjennomsnitt målte høyere verdier av nøytrofile granulocytter enn IFCM-metoden. Verdiene fra CellaVision DM96 før omklassifisering av cellene var lavere enn verdiene fra IFCM-metoden (tabell 2). Bland-Altman analysen viste at gjennomsnittsdifferansen var minst i sammenligningen mellom Sysmex XN og IFCM, og størst i sammenligningen mellom CellaVision etter omklassifisering av cellene og IFCM (tabell 2). Spredningen av differansene er vist i figur 1.
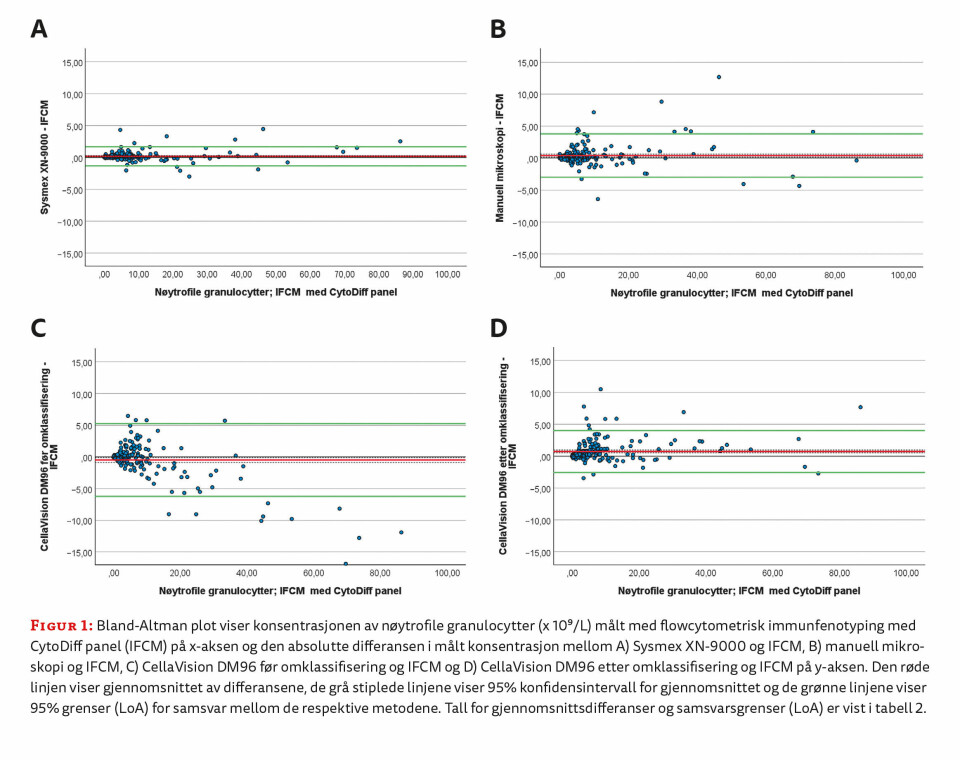
Spredningen av differansene og intervallet mellom nedre og øvre samsvarsgrense (LoA) var størst i sammenligningen mellom CellaVision DM96 før omklassifisering og IFCM (figur 1C). Her indikerer plottet at differansene varierer over måleområdet og at den observerte negative gjennomsnittsdifferansen i hovedsak kan tilskrives målinger over 15 x 109/L nøytrofile granulocytter. De øvrige sammenligningene viste ingen tegn til proporsjonal skjevhet, men enkelte uteliggere ble observert. Nedre og øvre 95 % samsvarsgrense (LoA) for sammenligningene er vist i tabell 2.
Nøytrofile granulocytter <0,50 x 109/L målt med IFCM og CytoDiff-panel
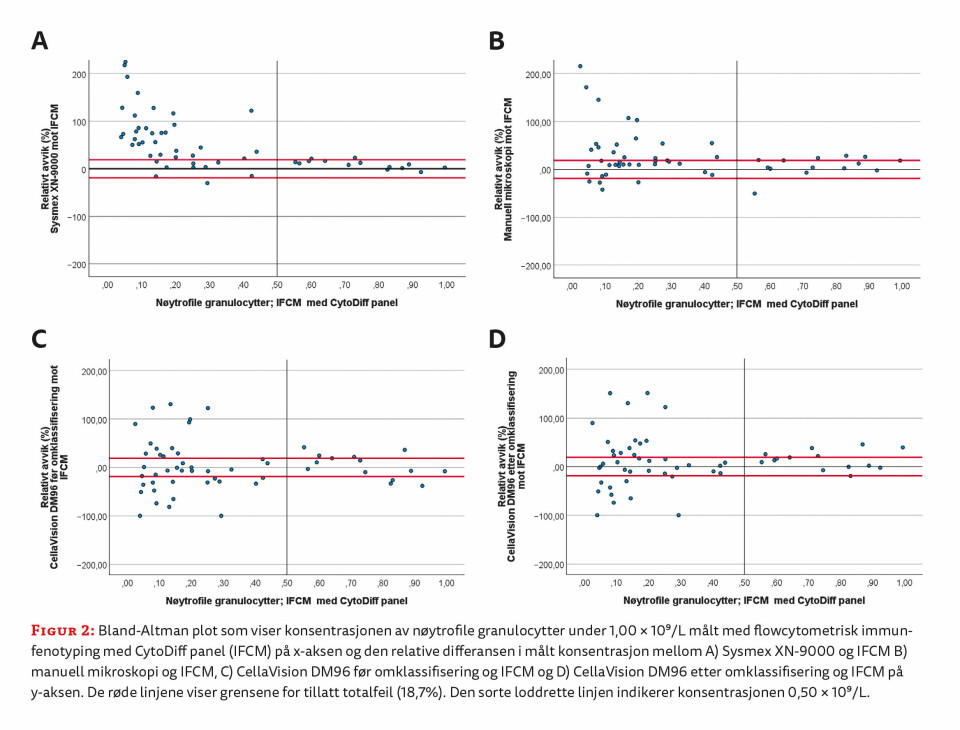
Totalt 33 av 41 relative differanser (80,1 %) ble observert utenfor grensene for tillatt totalfeil i sammenligningen mellom Sysmex XN og IFCM (figur 2A). «WBC Abn Scattergram» ble rapportert for 19 av de 33 prøvene (58 %). For manuell mikroskopi og CellaVision DM96 før og etter omklassifisering var antall relative differenser utenfor grensene henholdsvis 21 (51 %), 28 (68 %) og 24 (59 %) (figur 2B-D).
Nøytrofile granulocytter 0,50 – 0,99 x 109/L målt med IFCM og CytoDiff-panel
Totalt 2 av 14 relative differanser (14,3 %) ble observert utenfor akseptgrensene for totalfeil i sammenligningen mellom Sysmex XN og IFCM (figur 2 A). Ingen av prøvene med relativ differanse utenfor grensene ble rapportert med «WBC Abn Scattergram». For manuell mikroskopi og CellaVision DM96 før og etter omklassifisering var antall relative differenser utenfor grensene henholdsvis 5 (36 %), 7 (50 %) og 6 (43 %) (figur 2B-D).
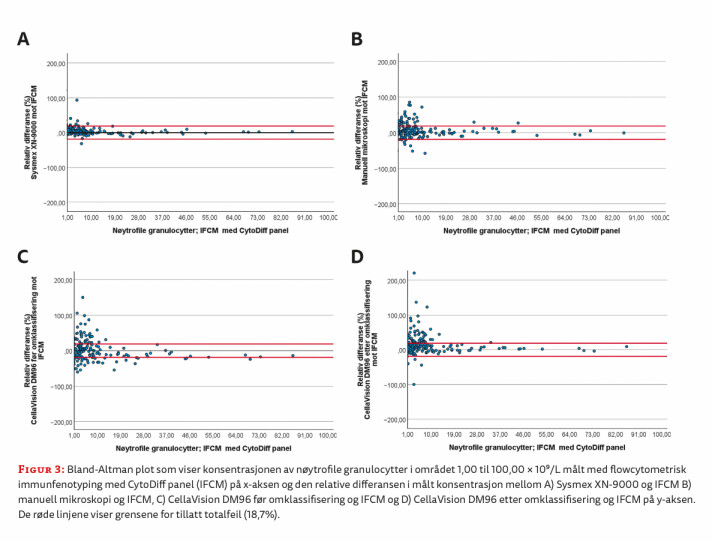
Nøytrofile granulocytter 1,00 – 86,29 x 109/L målt med IFCM og CytoDiff-panel
Totalt 8 av 153 relative differanser (5,2 %) ble observert utenfor akseptgrensene i sammenligningen mellom Sysmex XN og IFCM-metoden (figur 3A). «WBC Abn Scattergram» ble rapportert på 83 av 145 prøver (57 %) med differanser innenfor grensene og 6 av 8 prøver (75 %) med differanser utenfor grensen for tillatt totalfeil. For manuell mikroskopi og CellaVision DM96 før og etter omklassifisering var antall relative differenser utenfor grensene henholdsvis 39 (25 %), 71 (46 %) og 54 (35 %) (figur 3B-D).
Diagnostisk nøyaktighet
Krysstabellanalysen viste ingen sammenheng mellom rapportering av «WBC Abn Scattergram» og variabelen «relativ feil» (p= 0,890). Frekvensfordelingen er vist i tabell 3. Sensitiviteten og spesifisiteten til flagget ble beregnet til henholdsvis 0,58 (95 % KI: 0,42-0,73) og 0,43 (95 % KI: 0,35-0,51).

Diskusjon
I denne studien ble det undersøkt om nøytrofile granulocyttresultater merket med stjerne kan rapporteres uten å undersøke blodutstryk når Sysmex XN melder «Blast/Abn Lympho?». Videre ble det evaluert om «WBC Abn Scattergram» gir nyttig informasjon om hvilke prøver som presumptivt trenger oppfølging med alternativ metode. Totalt ble 208 blodprøver analysert ved bruk av Sysmex XN, CellaVision DM96 og manuell mikroskopi av blodutstryk, og sammenlignet med resultatene fra IFCM.
Det var god korrelasjon og høy grad av overensstemmelse mellom målingene fra Sysmex XN og IFCM for verdier i området 0,02-86,29 x 109/L.
For verdier i området 0,5-86,29 x 109/L lå 6 % av de relative differansene utenfor grensen for tillatt totalfeil. For verdier < 0,5 x 109/L overskred 80,1 % av de relative differansene grensene, med de fleste og største avvikene observert for verdier < 0,2 x 109/L. Dette kan skyldes mindre presise målinger ved lave verdier (17), samt at relativ endring gir større tallverdier enn absolutte forskjeller ved lave forekomster.
Sysmex XN viste en høyere grad av nøyaktighet i målingen av nøytrofile granulocytter enn blodutstryksmetodene. Ved sammenligningen med IFCM var den gjennomsnittlig systematiske feilen mindre, og samsvarsgrensene betydelig snevrere enn for de øvrige metodene. Disse funnene indikerer at nøytrofile granulocytter kan rapporteres fra Sysmex XN, også i tilfeller der instrumentene indikerer usikre resultater knyttet til flagget «Blast/Abn Lympho?». Dette funnet samsvarer med tidligere studier som viser at nøytrofile granulocytter kan gis ut fra Sysmex-instrumentene ved tilstedeværelse av flagg (17, 18), og utfordrer nytteverdien av de gjeldende retningslinjene som anbefaler blodutstryk for verifikasjon av usikre resultater.
Pasienter med lave nivåer av nøytrofile granulocytter har økt infeksjonsrisiko, og ved alvorlig nøytropeni (<0,5 x 109/L ) er dødeligheten høy. For verdier <0,5 x 109/L var målingene usikre med alle de undersøkte metoder. Imidlertid indikerer resultatene at nøytrofile granulocytter >0,2 x 109/L mest sannsynlig kan rapporteres fra Sysmex XN når «Blast/Abn Lympho?» rapporteres, uten behov for forsinkende bekreftelse i blodutstryk.
Å følge opp flagg og usikre resultater fra hematologiinstrumenter ved å undersøke blodutstryk er arbeidskrevende. I tillegg har metoden flere kjente feilkilder, inkludert feilklassifisering av celler, ujevn cellefordeling i utstryket samt en iboende statistisk usikkerhet i tellingene som følge av at et begrenset antall celler telles (19). Valget av passende laboratoriemetoder er derfor avgjørende for effektiv ressursutnyttelse i laboratoriet. Mange laboratorier benytter i dag digitale verktøy, som for eksempel CellaVision, for å følge opp usikre resultater og flagg fra hematologiinstrumentene. Imidlertid eliminerer ikke slike verktøy usikkerheten i tellingene, da det vanligvis telles et tilsvarende lavt antall celler som ved manuell mikroskopi. I tillegg er det en begrensning ved at kun et begrenset område av utstryket vurderes.
Riktig bruk av laboratorieundersøkelser har vært et sentralt tema i laboratoriemiljøer i flere tiår. I 2023 ga Helse- og omsorgsdepartementet helseregionene i oppdrag å redusere overforbruk av laboratorie-, bilde- og radiologitjenester ved å iverksette tiltak som fremmer kunnskapsbasert praksis, kvalitet, bærekraft og effektiv ressursbruk (20). Overforbruk i en laboratoriekontekst omfatter ikke bare analyser som bestilles uten klinisk begrunnelse. For hver blodprøve som analyseres på et hematologiinstrument genereres det flere titalls prøvesvar. Noen er bestilt av rekvirent, andre ikke. I tillegg vil det forekomme flagg og meldinger. Mange av disse har lav diagnostisk styrke (13, 21). Dette utgjør en betydelig etisk og ressursmessig utfordring. Spørsmål som ofte oppstår, inkluderer blant annet om laboratoriet skal følge opp stjernemerkede prøvesvar og flagg med alternative metoder. Hvordan skal disse i så fall følges opp? Skal flagg og ikke-bestilte analysesvar rapporteres til behandlende lege? Hvordan skal da legen forholde seg til denne informasjonen? Ansvar for kvalitet, bærekraft og effektiv ressursbruk kan ikke utelukkende tilskrives laboratoriene og kliniske avdelinger. Instrumentprodusenter og leverandører har også et vesentlig ansvar. Denne studien reiser spørsmål ved påliteligheten til stjernemerkingen av nøytrofile granulocytter analysert med Sysmex XN-serien.
Omfangsrike og defensive faglige retningslinjer representer ytterligere en faktor som bidrar til overaktivitet i laboratoriene. Sysmex XN-serien er utstyrt med et regelbasert valideringsverktøy som bygger på leverandørens erfaringer og publiserte retningslinjer (23). Vår studie viser at stjernemerkede nøytrofile granulocytter med fordel kan rapporteres fra Sysmex XN når prøven er merket med flagget «Blast/Abn Lympho?». Når det gjelder flagget «WBC Abn Scattergram», har tidligere studier antydet at nøytrofile granulocytter kan rapporteres fra hematologiinstrumentet Sysmex XE-2100 når flagget er tilstede (17). Vår studie bekrefter denne antagelsen. Vi fant ingen statistisk signifikant sammenheng mellom unøyaktigheten i målingene av nøytrofile granulocytter (relativ målefeil) og rapporteringen av «WBC Abn Scattergram» (p=0,890).
Intensjonen med Sysmex XN-seriens regelbaserte valideringsverktøy er sannsynligvis å sikre generell høy kvalitet på prøveresultatene. Denne studien antyder imidlertid at flaggene «Blast/Abn Lympho?» og «WBC Abn Scattergram» er lite egnet til å identifisere usikre nøytrofile granulocyttresultater. Målingene er mest sannsynlig pålitelige og oppfølging av stjernemerkingen med undersøkelse av blodutstryk fremstår som en driver for unødvendige undersøkelser. Laboratoriene bør derfor vurdere å etablere laboratoriespesifikke retningslinjer for å avgjøre hvilke flagg som kan ignoreres ved stjernemerkede resultater Dette vil kunne gi færre kontroller i blodutstryk som igjen kan forkorte svartiden (18) og redusere forsinkelser i pasientenes behandling.
Det kan argumenteres for å vurdere blodutstryk ved tilstedeværelse av flagg for å påvise blaster eller tegn til lymfoproliferativ sykdom, der slik sykdom ikke tidligere er påvist. Tidligere studier har imidlertid vist at det er stor risiko for falsk negative resultater når blodutstryk benyttes for å påvise blaster (13).
Konklusjon
Et sentralt funn i denne studien er at Sysmex XN måler nøytrofile granulocytter med større nøyaktighet enn blodutstrykmetodene i blodprøver rapportert med flagget «Blast/Abn Lympho?». Verdier ≤ 0,5 x 109 nøytrofile granulocytter/L har sannsynligvis tilstrekkelig nøyaktighet til å identifisere alvorlig nøytropeni, og kan dermed rapporteres fra Sysmex XN uten behov for undersøkelse av blodutstryk. «WBC Abn Scattergram»-flagget gir ingen indikasjon på hvilke prøver som krever oppfølging med alternative metoder. «Gjør kloke valg»-kampanjen oppfordrer til begrenset bruk av undersøkelser som ikke har en klar nytteverdi for pasientene, og i laboratoriekontekst kan dette innebære å overse flagg med lav diagnostisk nøyaktighet. Laboratoriespesifikke retningslinjer kan være veien å gå for å redusere overaktivitet og frigjøre kapasitet i laboratoriene. Vår studie indikerer at stjernemerkede nøytrofile granulocytter merket med «WBC Abn Scattergram»-flagget kan rapporteres fra Sysmex XN uten annen oppfølging. Det kan forkorte svartiden og spare ressurser.
Forfatternes bidrag
HE utformet studien, analyserte dataene, utførte statistiske analyser og utarbeidet manuskriptet. RMG deltok i diskusjon av resultatene og hjalp til med utforming av manuskriptet. JMA deltok i diskusjon av resultatene og hjalp til med utforming av manuskriptet.
Interessekonflikter
Ingen interessekonflikter































