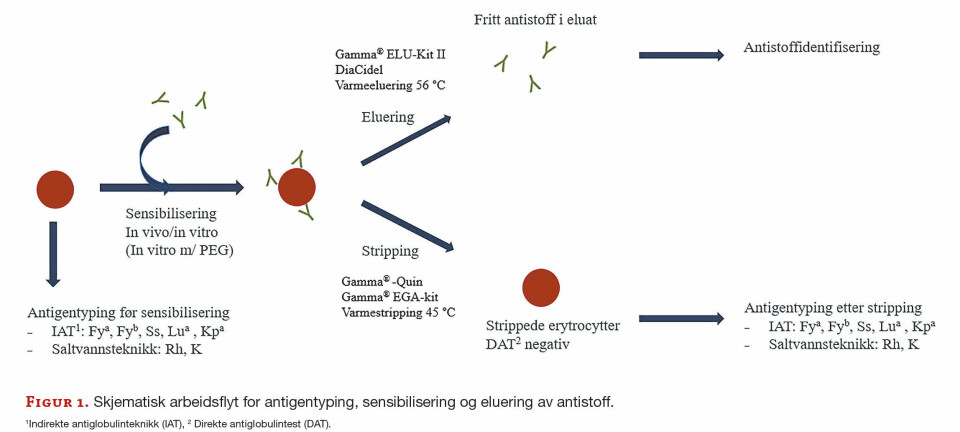
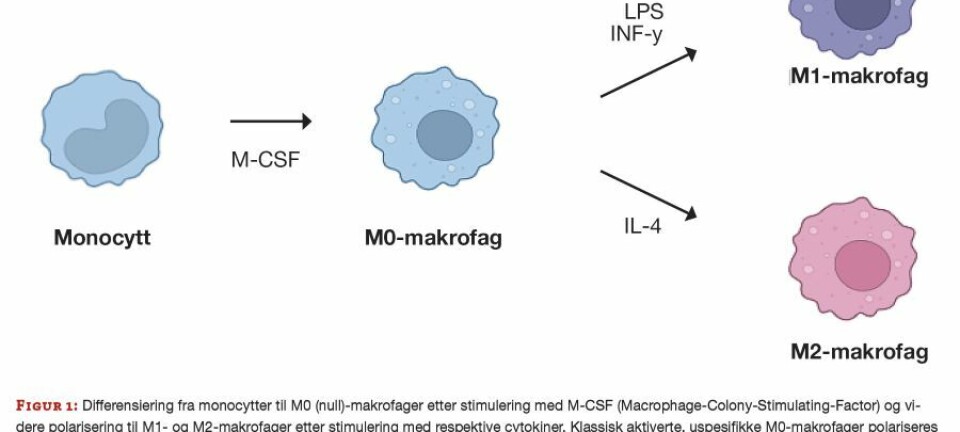
FAG Originalartikkel
RHD-genotyping ved bruk av allelspesifikk «Loop-mediated isothermal DNA Amplification»
Genotyping krever ofte avansert utstyr og kompetanse. Formålet med denne studien er å prøve ut «loop mediated isothermal amplification» (LAMP), et raskt og mindre ressurskrevende alternativ for RHD-genotyping.
RHD-genotyping ved bruk av allelspesifikk «Loop-mediated isothermal DNA Amplification».pdf(265 KB)
Med unntak av «ABO», er «Rh» det klinisk viktigste blodtypesystemet. Genetisk består det av to homologe, kodominante og tett koblede genloci på kromosom 1, RHCE og RHD. RH-genene har ti eksoner hver og koder for to forskjellige, men nært beslektede erytrocytære membranproteiner, RhCE og RhD. Sistnevnte uttrykker det mest immunogene Rh-antigenet, D. Omtrent 15 prosent av nordmenn er RhD-negative (1), noe som oftest skyldes delesjon av hele RHD-genet (2).
Når RhD-negative personer kommer i kontakt med D-antigenet, som regel gjennom graviditet med et RhD-positivt foster eller blodtransfusjon med RhD-positivt blod, danner noen anti-D, et antistoff som kan forårsake hemolytisk sykdom av fostre/nyfødte og alvorlige transfusjonsreaksjoner (3). Derfor er det viktig å kjenne til RhD-statusen til pasienter, gravide og blodgivere. Serologisk fenotyping av RhD er rutine i alle norske blodbanker, men av og til er serologi alene utilstrekkelig eller utilgjengelig. Dette gjelder for eksempel blodgivere med betydelig svekket/avvikende RhD-uttrykk på grunn av mutasjoner i RHD-genet, men også noninvasiv prenatal fosterdiagnostikk der det brukes genotyping av fritt føtalt DNA i maternalt plasma for å bestemme fosterets RhD-fenotype og styre prenatal Rh-profylakse (4). Flere PCR-baserte metoder for RHD-genotyping er beskrevet (5). Det er imidlertid en utfordring i den laboratoriemedisinske hverdagen at alle disse avhenger av avansert utstyr og høyspesialisert kompetanse, slik at RHD-genotyping per i dag er begrenset til referanselaboratorier.
Formålet med vår studie var å prøve ut Loop-Mediated-Isothermal-Amplification (LAMP) som er en forholdsvis ny og enkel teknikk for amplifisering av DNA eller RNA (6). Metoden legger til rette for å kunne utføre DNA-baserte analyser i mindre velutstyrte laboratorier og med lavere krav til teknisk kompetanse.
I motsetning til PCR, skjer amplifiseringen ved konstant temperatur (isotermisk), og kan derfor utføres med enkel varmeblokk eller til og med i vannbad. I tillegg til å være en enkel metode, kan sensitiviteten til LAMP være 100 - 1000 ganger høyere enn standard PCR, på linje med de mest avanserte real-time-PCR-metodene (7). Avlesning av resultatet, det vil si deteksjon av produktet, kan gjøres visuelt uten bruk av avansert utstyr. Essensielt i teknikken er at reaksjonen foregår ved 60 – 65˚C, hvor trådene i DNA-molekylet er i konstant skifte mellom hybridisering og denaturering.
Videre er det sentralt at DNA-polymerasen som benyttes har strand displacement-egenskap, det vil si at den kan skille DNA-trådene nedstrøms for syntesen.
Figur 1 viser prinsippet for LAMP. I tillegg til de beskrevne primerne i figur 1, kan man bruke et ekstra sett med loop primers (LF og LB) som hybridiserer til den enkelttrådige loopen i LAMP-produktet (8). Dette effektiviserer amplifiseringen, og er benyttet i dette arbeidet.
Vi beskriver i denne artikkelen hvordan man ved hjelp av LAMP kan, med høy sensitivitet og spesifisitet, utføre RHD-genotyping på renset DNA så vel som på enkle slimhinnecelleprøver.
Materiale og metode
EDTA-fullblod ble tappet fra 15 frivillige personer etter informert samtykke. Alle prøvene ble anonymisert før feno- og genotyping for RhD. RhD fenotyping ble gjennomført i rørteknikk etter blodbankens standardprosedyre (9). Resultatene fra denne RhD-typingen ble brukt som gullstandard, og benyttet til å bekrefte riktigheten av resultatene fra genotyping ved LAMP-analyse (tabell 2). DNA ble isolert fra 100 µl av fullblodprøvene ved hjelp av DNeasy Blood & Tissue Kit (Qiagen) ved å følge produsentens anbefalte prosedyre. Konsentrasjon og renhet av isolert DNA ble målt på NanoDrop spektrofotometer (Thermo Scientific).
DNA fra epitelceller fra kinn ble isolert ved en enkel prosedyre: Fire av forsøkspersonene skylte munnen med 5 ml fysiologisk saltvann. 1,5 ml av dette ble sentrifugert ved 9000 g i to minutter, og pellet ble resuspendert i 200 µl H2O før prøven ble inkubert i vannbad ved 100 ˚C i 10 minutter. Prøvene ble satt på is i fem minutter og deretter sentrifugert ved 9000 g i 30 sekunder. Alle DNA-prøver ble lagret ved -20 ˚C.
LAMP-analyse ble utført i 25 µl reaksjonsvolum med følgende sammensetning: 20 mM Tris-HCl (pH 8,8), 10mM KCl, 8 mM MgSO4, 10 mM (NH4)2SO4, 0,10 % Tween-20, 0,8 M Betaine, dNTP mix (1,4 mM av hvert nukleotid), 120 µM Hydroxy naphtol blue (HNB, Sigma-Aldrich), primere: 1,6 µM FIP og BIP, 0,2 µM F3 og B3 og 0,8 µM FL og BL, 8U Bst 2.0 warm start DNA polymerase (New England Biolabs). Templat-DNA til LAMP ble først varmet opp i varmeblokk til 95 ˚C i to minutter og deretter kjølt ned på is i to minutter. 2 µl DNA ble deretter blandet med 23 µl reaksjonsløsning og inkubert i varmeblokk (2720 Thermal Cycler, Applied Biosystems) ved 63 ˚C i 75 minutter etterfulgt av 80 ˚C i 15 minutter for inaktivering av enzym. Primerne er designet ved hjelp av online software Primer Explorer (http://primerexplorer.jp/e/). Primere for spesifikk amplifisering av RHD-genet og kontrollgenet beta-aktin er vist i tabell 1.
Avlesning ble gjort manuelt i denne studien. Fargeskifte fra fiolett til lys blå indikerer pyrofosfatproduksjon når nukleinsyrer blir amplifisert og derved en positiv LAMP-analyse (figur 2).
For test av analytisk sensitivitet og allelspesifisitet til LAMP-analysen, ble det laget to 5 x fortynningsrekker av RHD-positivt DNA både i H2O og i RHD-negativt RHCE-positivt DNA med konsentrasjon 1,14 ng/µl (tabell 3). Begge fortynningsrekkene ble analysert i triplikater med den beskrevne LAMP-prosedyren.
Resultater
15 personer ble RhD-feno- og genotypet med blodtypeserologiske standardmetoder og LAMP. Tabell 2 dokumenterer 100 prosent samsvar mellom RHD-geno- og RhD-fenotyper for renset (blodprøver) og urenset (munnskyllprøver) DNA. Alle kontroller viser forventet resultat, positivt for kontrollgenet beta-aktin og negativt for reaksjonene uten DNA. Sensitivitetsanalysen viser at vår LAMP-prosedyre kan detektere ned til 9,6 pg RHD-positivt DNA i 25 µl reaksjonsvolum (tabell 3). I tillegg viser vi at det er mulig å gjenfinne 9,6 pg RHD-DNA i 2280 pg «villtype» RHCE-DNA (25µl x 91,2 pg/µl = 2280 pg, tabell 3, rad b). RHD-positivt DNA kan altså detekteres i en bakgrunn av inntil 99,6 prosent RHD-neg/RHCE-pos DNA. Analytisk spesifisitet kan dermed demonstreres helt ned til sensitivitetsgrensen.
Diskusjon
Metode og resultater
Denne studien introduserer Loop-Mediated-Isothermal-Amplification som en ny og enkel metode for allelspesifikk genotyping av RHD. LAMP er en rask, sensitiv og spesifikk nukleinsyre-amplifikasjonsteknikk som er i ferd med å etableres i kliniske laboratorier, spesielt innenfor patogendeteksjon (11). Allelspesifikk LAMP er imidlertid mindre etablert, siden det er kjente utfordringer knyttet til metodens analytiske spesifisitet hvis sekvensforskjellene mellom allelene er små (12).
For å designe spesifikke primere for RHD har vi derfor valgt en 178-baseparregion i ekson 7 med flere nukleotider forskjell mellom RHD og RHCE (figur 3), slik at muligheten for krysshybridisering med RHCE-DNA blir lavest mulig.
Resultatene viser at LAMP-analysen har høy analytisk spesifisitet med fullt samsvar mellom RhD geno- og fenotyper. Det har vært mulig å detektere 0,4 prosent RHD-positivt DNA i en bakgrunn av RHCE-positivt DNA (tabell 3). Den analytiske spesifisiteten er sammenlignbar med den nyeste generasjonen av allelspesifikk PCR («droplet-AS-PCR»), det vil si 0,1 - 5 prosent detekterbar «mutant» DNA i en «villtype» bakgrunn (13). Dette er tilstrekkelig for de fleste kliniske bruksområder, blant annet prenatal RhD-diagnostikk, siden føtalt DNA utgjør ca. 3,4 - 6,2 prosent av total DNA i maternalt plasma, riktignok med store individuelle variasjoner (14).
Likeså vurderes den analytiske sensitiviteten som høy; vi kunne påvise mellom 9,6 pg og 48 pg RHD-positivt DNA i 25 µl reaksjonsvolum, tilsvarende omtrent den DNA-mengden som finnes i henholdsvis 1,5 og 7,5 humane cellekjerner (15). Dette er nær grensen til teoretisk mulig sensitivitet og er godt nok for de aller fleste formål, inklusivt deteksjon av føtalt DNA i maternalt plasma (14). Sensitiviteten er helt på linje med avanserte PCR-baserte RHD-genotyping-metoder (16). De to fortynningsrekkene (fortynnet i vann og RHCE-positivt DNA) viser reproduserbar deteksjon til henholdsvis 4. og 5. fortynning (48 og 9,6 pg RHD-positivt DNA i den påfølgende 25 µl LAMP-reaksjon). Grunnen til denne forskjellen kan vi per i dag ikke forklare. Dette må undersøkes i nye studier, for eksempel ved flere replikater eller nærmere studier av LAMP-produktene ved hjelp av DNA-sekvensering.
Analysemetoden vi beskriver stiller lave krav til kvaliteten på materialet som skal undersøkes. Analysene av munnskyllprøvene, hvor varmebehandlede epitelceller brukes som templat (tabell 2), bekrefter at urenset DNA kan brukes for allelspesifikk LAMP (17).
Svakheter og mangler
RHD-genotyping kan være komplisert. Det er derfor spesielt viktig å se separat på analytisk og diagnostisk spesifisitet og sensitivitet. Flere enn 200 RH-alleler er kjent, og mange av dem kan gi opphav til svekket eller strukturelt avvikende D-uttrykk på erytrocyttene (18). De fleste RhD-varianter er sjeldne, og deres kumulative frekvens estimeres til 1 – 2 prosent i et multietnisk, kaukasisk dominert samfunn (19, 20). Noen få av disse kan gi opphav til falske positive eller falske negative resultater når kun én RHD-genregion types (21). Dette er for tiden et lite problem i Norge, men kan være en reell utfordring i andre verdensregioner. Nullallelet RHDΨ, finnes for eksempel ikke sjeldent hos personer av afrikansk etnisitet (estimert til 3,3 - 6,7 prosent av befolkningen) og vil kunne forårsake falske positive prøvesvar når kun RHD ekson 7 types (22). Internasjonalt brukes det derfor minst to forskjellige genområder for RHD-genotyping, noe som kan bidra til økt klinisk spesifisitet i etnisk blandete samfunn (23).
I denne studien har vi kun analysert ekson 7 i RHD for å demonstrere at LAMP fungerer til å påvise genet. Den analytiske sensitiviteten og spesifisiteten har vært høy, men for å kunne skille diagnostisk mellom de ulike og sjeldne RH-allelene som er nevnt, vil man inkludere analyse av flere eksoner i fremtidige undersøkelser. Per i dag er den diagnostiske sensitiviteten og spesifisiteten av metoden i den norske populasjonen ukjent.
Perspektiv
Denne studien underbygger nyere resultater som viser at LAMP, ved omhyggelig primerdesign, kan være effektiv til å skille mellom lignende alleler. Metoden har vært benyttet til å skille mellom DNA-sekvenser med kun én base forskjell (24). For å kunne implementere RHD-LAMP i rutinediagnostikk er det imidlertid noe som gjenstår: Passende design av LAMP for flere RHD-eksoner må utvikles og det må kunne vises hvorvidt LAMP-primere kan skille andre RHD-eksoner fra liknende sekvenser i RHCE. Det bør implementeres en intern amplifikasjonskontroll som kan kjøres i samme brønn som selve RHD-reaksjonen. Dette oppfattes ofte som god praksis ved diagnostisk bruk av nukleinsyreamplifikasjonsmetoder (25). Det må dessuten inkluderes flere personer i en klinisk realistisk setting for å kunne fastslå hvorvidt RHD-genotyping ved hjelp av allelspesifikk LAMP er brukbar i rutinediagnostikk.
Konklusjon
Genotyping av 15 personer viser at LAMP-teknikken prinsipielt kan benyttes i påvisning av RHD-genet. Det er imidlertid for få eksoner, for få personer og for snever etnisk bakgrunn for å betrakte LAMP-RHD-genotyping som ferdig validert. Sensitiviteten og spesifisiteten er høy i denne studien, og indikerer at metoden er sensitiv nok til å påvise konsentrasjoner av mål-DNA som er like lave som fritt føtalt DNA i serum hos gravide kvinner. Videre studier vil vise om metoden kan benyttes klinisk til slik genotyping. Dersom man finner at LAMP kan benyttes til dette, vil metoden kunne tas i bruk i land med begrenset tilgang til velutstyrte laboratoriefasiliteter, hvor etablerte analysemetoder vanskelig kan benyttes.