FAG Oversiktsartikkel
MikroRNA - små molekyler med stor betydning i genregulering
MikroRNA - små molekyler med stor betydning i genreguleringen.pdf(149 KB)
Alle celler i kroppen har det samme arvematerialet (gener), men bare en del av genene blir transkribert (er aktive) i ei bestemt celle og under bestemte forhold. Hvilke gener som til enhver tid er aktive, avhenger av hvilke stimuli cellen blir utsatt for. Dette vil være ulikt for ulike celler og vev, og avhengig av hvor i utviklingen en organisme er. Sykdom vil eksempelvis påvirke hvilke gener som uttrykkes. Transkripsjon reguleres av både generelle og promotorspesifikke transkripsjonsfaktorer (proteiner). I de seneres år har også mikroRNA sin rolle blitt kartlagt.
Materiale og metode
Artikkelen er basert på et ikke-systematisk PubMed-søk (http://www.ncbi.nlm.nih.gov/PubMed/). I tillegg er følgende databaser benyttet; Expasy Proteomic server (http://us.expasy.org/) og Sanger Institute (http://www.sanger.ac.uk/)
Relevante artikler ble valgt ut på grunnlag av tittel og sammendrag, samt forfattere/fagmiljø og faglig nivå på tidsskriftet hvor artiklene er trykt.
miRNA - en stor familie av genregulatorer
MikroRNA (miRNA) er enkelttrådet RNA med en lengde på 21-23 nukleotider (nt) som bidrar til sekvensspesifikk genregulering. miRNA finnes i planter og dyr, de er ikke-kodende, det vil si at de blir ikke translatert til protein. Man antar at det humane genomet inneholder ca 1000 miRNA (http://microrna.sanger.ac.uk/). Ett bestemt miRNA kan regulere hundrevis av målgener, og et spesifikt målgen kan reguleres av flere ulike miRNA.
miRNA har nå vist seg å være en sentral regulator av genekspresjon og styrer prosesser som differensiering, cellevekst og apoptose, og man antar derfor at miRNA har en sentral rolle i sykdomsutvikling. miRNA utgjør én - fire prosent av alle uttrykte transkript i det humane genomet, noe som gjør miRNA til den største klassen av genregulatorer. miRNA grupperes i familier etter sekvenslikhet i 5`-enden av modent miRNA, men hvorvidt miRNA innen samme familie kontrollerer de samme biologiske hendelsene, er fortsatt uvisst (1).
Oppdagelsen av miRNA
I 1990 forsøkte en gruppe plantebiologer å forsterke den blårøde fargen til petuniaplanten ved å øke syntesen av anthocyanin. Dette ble gjort ved å overuttrykke enzymet chalcone synthase (medfører økt syntese av anthocyanin) i planteceller. Uventet ble resultatet petuniaplanter som var hvite eller hvitflekkede (figur 1). Fenomenet ble kalt co-suppression, men mekanismene bak var ukjente. (2,3).

Tre år senere (1993), innenfor fagområdet utviklingsbiologi og ved bruk av nematoden C. Elegans som modellsystem, ble det identifisert to lin-4 transkript, hvor det minste transkriptet var komplementært til repeterende sekvenser i 3`-ikke-translatert område av genet lin-14 mRNA (4). Disse funnene tydet på at lin-4 kunne regulere lin-14 translasjon via en anti-sense RNA: mRNA interaksjon, og dermed spille en viktig rolle i utviklingen av C. Elegans. Det ble vist at denne reguleringen var avgjørende for å komme fra larvestadiet i postembryo utviklingen i C. Elegans, og studien var den første som beskrev funksjonen til endogent miRNA.
Den biologiske betydningen av miRNA fikk ytterligere fokus da Fire et al (5) skaffet bevis for at dobbelttrådet (ds)RNA deltok i et fenomen kalt RNA interferens (RNAi). Andrew Fire og Craig Mello fikk senere Nobelprisen i Fysiologi og Medisin (2006) for sine funn; dsRNA induserte en mer potent genetisk interferens enn enkelttråd i C Elegans. Senere ble post-transkripsjonell ”gene-silencing” kartlagt som en naturlig antiviral forsvarsmekanisme, med blant annet arbeidet til Hamilton et al. (6), hvor man observerte tilstedeværelse av anti-sense viralt RNA i virusinfiserte planter. Deretter kom to studier som tydet på at dsRNA på 21-23 nt var i stand til å degradere mRNA (7,8). miRNA ble definert som en ny familie av små endogene RNA. miRNA-familien har stor diversitet i sekvens og ekspresjonsmønster, er evolusjonsmessig utbredt og er involvert i sekvensspesifikk, posttranskripsjonell regulering av genekspresjon (9-11).
Dannelse og prosessering
Biogenesen av miRNA innebærer flere enzymatiske trinn hvorav noen av de viktigste er skissert i figur 2. miRNA blir transkribert av RNA Polymerase II, og det blir initielt syntetisert et primært transkript, såkalte pri-miRNA (Fig 2). Disse pri-mRNA blir prosessert i kjernen av RNAse II enzymet Drosha til et 70 nt pre-miRNA (12-14) som foldes til en perfekt hårnålsstruktur (15). Pre-miRNA blir deretter eksportert til cytoplasma av exportin 5, og prosesseres videre til modent og funksjonelt miRNA (21-23nt) ved hjelp av endonukleasen Dicer (15). Det modne miRNA danner hjørnet i RISC-komplekset (RNA-indusert silencing complex). RISC kløyver og degraderer mRNA eller undertrykker translasjonen av mRNA (figur 2).
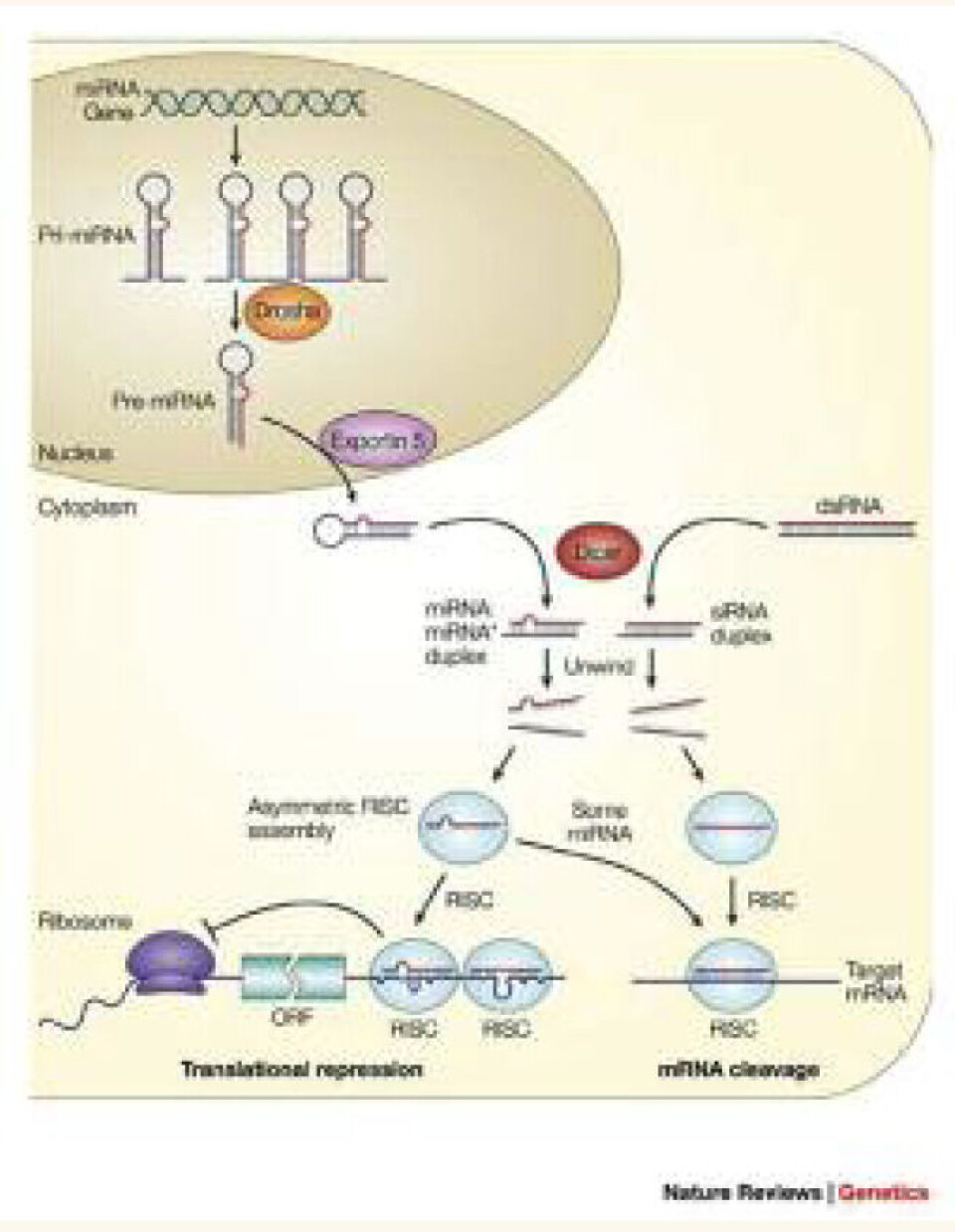
miRNA-transkriptet hemmer genuttrykket på en av to måter, avhengig av grad av komplementaritet mellom miRNA og målgen. Ved fullstendig komplementaritet binder miRNA seg til mRNA og fører til at mRNA degraderes. Ved ufullstendig komplementaritet hemmer miRNA translasjon ved å binde seg til 3`- utranslatert område av mRNA.
miRNA og kreft
Det første belegget for at miRNA kunne være involvert i kreft kom fra en studie hvor man fant at miR-15a og miR-16-1 var lokalisert innen en 30 kb delesjon funnet i kronisk lymfatisk leukemi (CCL), og at disse transkriptene var borte eller lite uttrykt i de fleste tilfellene av denne kreftformen (16). Denne delesjonen forekom også i 16 - 40 prosent i multiple myelom og i 60 prosent av prostatakreft. Det ble derfor antatt at tumorsuppressor-gener må ligge innenfor denne regionen. I hypofyseadenomer finner man også nedregulering av miR-15a og miR-16-1, og nivået av nedregulering korrelerer med størrelsen på tumorens diameter, noe som tyder på at disse miRNA hemmer tumorvekst (17).
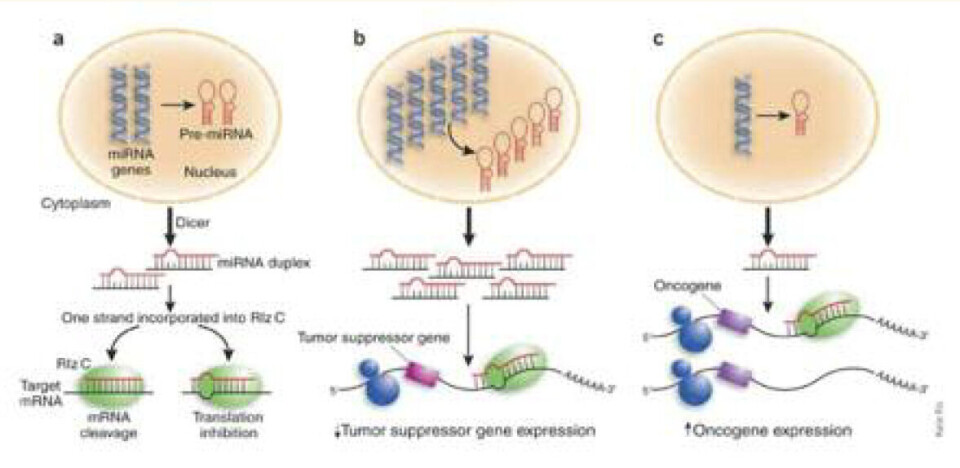
Det er også vist nylig at miR-15a og miR-16-1 hemmer bcl-2, som er et anti-apoptotisk gen som ofte er overuttrykt i ulike kreftformer (18). Delesjon av eller nedregulering av miR-15a og miR-16-1 fører til økt uttrykk av Bcl-2 proteinet, og følgene blir økt cellevekst. Rollen til miR-16-1 i kreft har blitt ytterligere forsterket ved at man har funnet kimcellemutasjoner i transkriptet miR-16-1 og vist at dette ofte er nedregulert i leukemier. miRNA sin påvirkning av tumorsuppressor og onkogener er forklart i figur 3.
Andre studier har også vist en sterk sammenheng mellom opphevet uttrykk av miRNA og kreftutvikling. Modent miRNA-nivå av miR-143 og miR-145 er signifikant redusert i tykktarmskreft (19). Interessant i denne sammenheng er at man finner hårnålsstruktur av pre-miRNA transkript i samme mengde i normalt og i sykt vev, noe som indikerer at det er prosesseringen av miR-143 og miR-145 som kan være ødelagt i disse cellene. Den samme miRNA-nedreguleringen er også observert i andre kreftformer (bryst, prostata, cervix mfl).
P53-proteinet er en tumorsuppressor som stopper celledeling og øker apoptose ved DNA-skade, onkogent stress og liknende. Nylig ble flere miRNA som er regulert av transkripsjonsfaktoren P53 identifisert (20-22). Studiene viser miR-34a og miR-34 b/c som direkte og konserverte p53 målgener, og at disse miRNA forårsaker induksjon av apoptose, cellesyklusarrest og cellealdring. miR-34 ser ut til å være en sentral mediator av p53-funksjonen. Eksperimentelle forsøk hvor man overuttrykte miR-34 førte til cellesyklusarrest i G1 fasen. I en annen studie fant man at miR-34b og miR 34c hemmet proliferasjon og kolonidannelse in vitro (23). Ved å hemme miR-34 i cellelinjer, fant man at hastigheten for apoptose indusert av DNA-skade ble sterkt redusert (24).
En nyere studie viser at cirka 50 prosent av alle kjente miRNA-sekvenser er lokalisert på områder av genomet som er assosiert med kreft, såkalte fragile områder. MiR-125b-1, en homolog av C. Elegans lin-4, er lokalisert på kromosom 11q24, og dette området er ofte borte i bryst-, lunge-, ovarie- og livmorhalskreft (25).
En annen studie knytter miR-125b-1 til leukemi, og beskriver en pasient med B-celle akutt lymfoblastisk leukemi hvor man fant en insersjon av denne miRNA i lokus til IgG tunge kjede lokus (26). Denne studien tyder på at miR-125b-1 kan fungerer som et oncomir (fremmer kreftutvikling). En annen studie viser at miR-21 er oppregulert i glioablastom (27); miR-21 ble funnet å være uttrykt 5-100 ganger mer i tumor sammenliknet med normalt vev. Ved å slå ut miR-21 i gliomaceller, fant man at miR-21 kontrollerte cellevekst ved å hemme apoptose, noe som tyder på at miR-21 har en onkogen rolle i denne kreftformen.
miRNA brukt i diagnostikk
miRNA kan vise seg å være nyttig i klassifisering av kreftformer, og langt bedre enn den mer vanlige klassifisering foretatt ved hjelp av mRNA ekspresjonsanalyser. Lue et al. (28) benyttet miRNA mikroarray teknologi (høykapasitetsanalyser) for å undersøke systematisk profilen til 217 miRNA transkript i primære tumorer, tumorderiverte cellelinjer og i normalt vev. Resultatet viste at miRNA har ulik profil i kreft sammenliknet med normalt vev, og profilene varierer med de ulike kreftformene. Man fant også at profilene var overraskende informative ved at de gjenspeiler kreftens utviklingslinje og differensieringsstadium.
Også andre studier tyder på at miRNA kan benyttes diagnostisk og prognostisk. Nylig ble det vist at let-7, miR-181b og miR-200C var overrepresentert i kreftmateriale fra tykktarm sammenliknet med normalt vev. Uttrykket av let-7 og miR-181b var assosiert med en klinisk respons til kjemoterapi, men var likevel ikke en signifikant prognostisk markør for overlevelse (29).
miRNA-terapi
Oppdagelsen av miRNA som viktige krefthemmende transkripter vil sannsynlig få stor betydning i genterapi, hvor man ønsker å blokkere tumorprogresjon. Storskala screening, hvor man sammenlikner miRNA-nivået i tumor versus normalt vev, vil være nyttig for å identifisere nye miRNA som er involvert i kreft. I framtida vil man forvente at syntetiske anti-sense oligonukleotider, som koder for sekvenser som er komplementære til modne onkogene miRNA (såkalte antagomiR), effektivt kan inaktivere miRNA i kreft og hemme veksten. Bruk av slike antagomiR konjugert med kolesterol, har vist seg å være effektivt for å hindre miRNA-aktivitet i ulike organ når de injiseres i mus, og kan bli et lovende terapeutisk agens (30). Omvendt, teknikker for å overuttrykke miRNA som fungerer om tumorsuppressorer, kan bli brukt for å hemme spesifikk tumorvekst.
RNA-interferens som molekylærbiologisk verktøy
Den selektive og robuste effekten av RNA-interferens (RNAi) på genekspresjon, gjør RNAi til en verdifull teknikk som benyttes i molekylærbiologisk forskning, både i cellekulturer og i levende organismer (C. Elegans er mye brukt). Syntetiske siRNA (small interference RNA) eller sh-RNA (short-hairpin RNA) med en sekvens komplementær til spesifikke gener, kan transfekteres inn i celler. Man kan deretter undersøke den biologiske effekten av å “slå ut et gen” (for eksempel se på effekten på vekst, apoptose, migrasjon, lokalisasjon). RNAi kan også benyttes for storskalascreening hvor man systematisk slår ut ett og ett gen i ei celle, noe som kan hjelpe til å identifisere de komponentene som er nødvendige i en spesiell cellulær prosess eller en hendelse (eksempelvis celledeling).
Konklusjon
MikroRNAs rolle i genregulering er fortsatt for det meste ukjent, men forskningsresultater så langt tyder på at denne familien av regulatorer har stor betydning i transkripsjonell aktivering og hemming av genuttrykk. Ny kunnskap om miRNA åpner for bedre diagnostikk, prognostikk og forhåpninger om at miRNA kan benyttes i behandling av sykdommer.