FAG Originalartikkel
Comet assay – en sensitiv metode for måling av DNA-skade og DNA-reparasjon
Comet assay_en sensitiv metode for måling av DNA_skade og DNA_reparasjon.pdf(685 KB)
Materialer og metoder
Artikkelen er basert på hovedforfatters forskningserfaring gjennom 20 år. Metodologien og den historiske bakgrunnen er beskrevet i detalj i artikkelen "The Comet assay for DNA damage and repair" fra 2004 (1), og i en oversiktsartikkel fra 2008 (2).
DNA-skade, DNA-reparasjon og kreft
Man tenker seg DNA som et svært stabilt molekyl. Denne stabiliteten er riktig nok essensiell for at cellen skal fungere, men cellene i kroppen bombarderes uavbrutt av agenser som kan forårsake skade på DNA. I tillegg går tusener av purinbaser tapt hver dag ved spontan hydrolyse. Skadelige agens kan komme utenfra, slik som UV-stråling eller en rekke kjemiske stoffer, eller de kan oppstå inne i kroppen. For eksempel blir frie radikaler (også kalt reaktive oksygensubstanser, ROS) frigjort under normal celleånding i mitokondriene. Til tross for det kraftige antioksidantforsvaret, inkludert enzymer som håndterer frie radikaler, og det svovelhydroksylrike peptidet glutation, vil noe DNA-skade uunngåelig oppstå. Andre forsvarslinje er da DNA-reparasjon. Det finnes distinkte reparasjonsveier for ulike former for DNA-skade, fra helt enkel skjøting av enkelttrådig DNA-brudd, til den komplekse nukleotid-eksisjons-reparasjonen (NER) som tar seg av store DNA-addukter og UV-induserte forvridninger av dobbeltheliksen. Med N
ER blir en oligonukleotid som inneholder skade fjernet, og en ny streng syntetisert for å fylle tomrommet. Det finnes en tredje forsvarslinje, programmert celledød (apoptose), som iverksettes dersom skaden har ført til en for stor belastning for cellen.
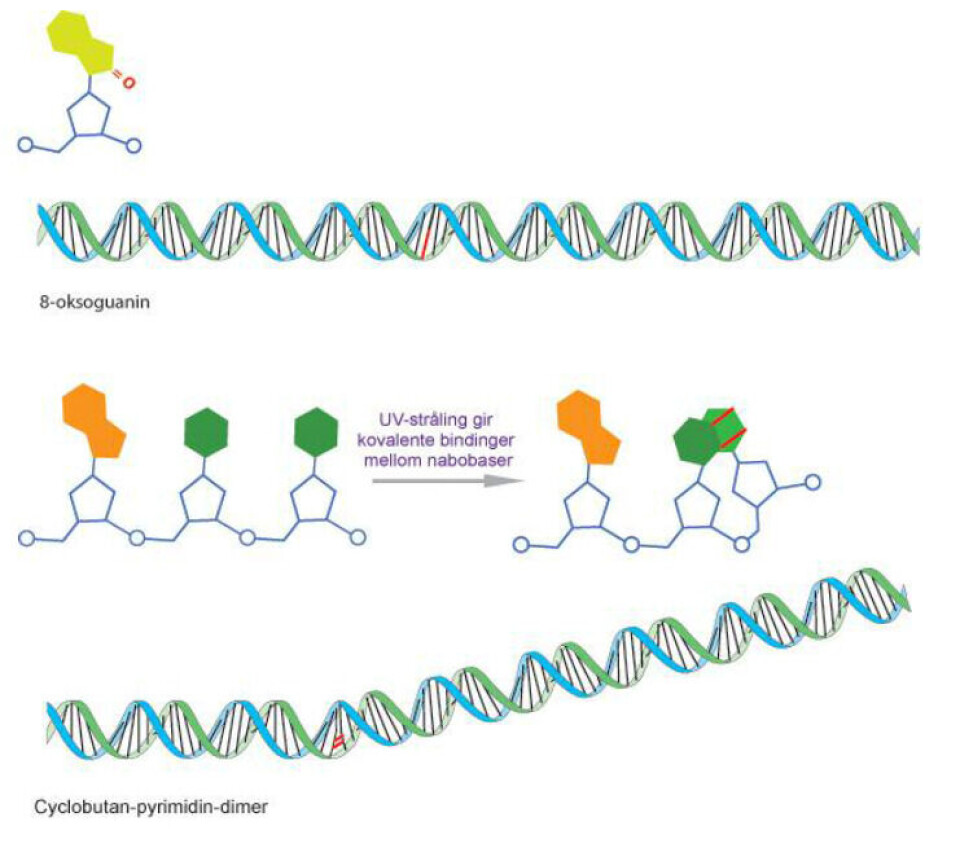
Eksempler på DNA-skade forårsaket av reaktivt oksygen og UV-stråling er vist i figur 1.
Det er flere grunner til at det er viktig å kunne måle DNA-skade. Ureparerte DNA-skader som er til stede når cellen kopierer DNA kan forårsake feil paring av baser, noe som gir mutasjoner. For eksempel har 8-oksoguanin en tendens til å danne par med adenin istedenfor cytosin. DNA-skade er første trinnet på veien mot en fenotype med uregulert celledeling, noe som kjennetegner kreft (3).
Måling av DNA-skade med Comet assay
Comet assay (enkeltcelle gelelektroforese) er en 25 år gammel metode for å måle DNA-skade, utviklet av de to svenske forskerne Olle Östling og Karl J. Johanson (4). De kapslet inn celler i agaorosegel på mikroskopiplater og behandlet gelen med en løsning av SDS-detergent og EDTA for å løse opp cellene, slik at DNA ble igjen i strukturen kalt nukleoid. Det var tidligere fastslått av Peter Cook og andre (5), at et nukleoid består av DNA som er supercoilet (tvunnet) ettersom det har vært organisert i nukleosomer og koblet i intervaller til et kjernenettverk (matriks). Koblingene til matriksen holder igjen DNA-tråden slik at supercoilingen ikke rakner selv etter at histonene har blitt borte. DNA-tråden er i realiteten nå en serie slynger definert ved koblingspunktene til matriksen.
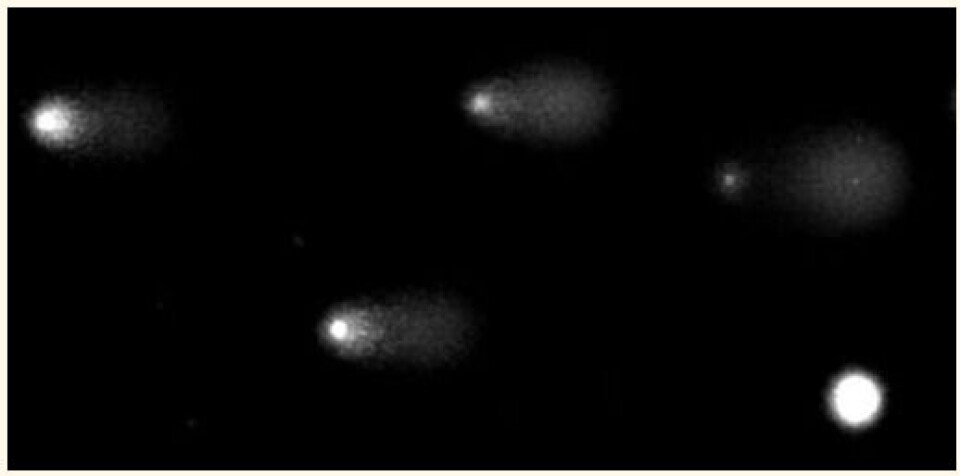
Östling og Johanson kjørte elektroforese på gelene ved pH 9.5 (ikke så høyt at DNA ble denaturert) og farget dem med acridineorange for visualisere DNA. De observerte kometlignende avbildninger av DNA som strålte ut av nukleoidkjernen og dannet en ”hale”. De undersøkte celler som hadde blitt behandlet med ulike doser av stråling, og fant en jevn økning i andelen av den totale fluorescensen (og derfor av DNA) som dukket opp i halen ettersom dosen ble økt. Ioniserende stråling (røntgenstråling eller gammastråling) forårsaker DNA-brudd, for det meste enkelttrådig. Forskernes forklaring var at DNA-bruddene hadde løst opp supercoilingen av DNA, slik at mer og mer DNA ble fritt og ble slynget ut i en hale mot anoden (se rammetekst).
Den praktiske betydningen av metoden til Östling og Johanson ble ikke bredt anerkjent. Noen år senere ble imidlertid den alkaliske versjonen av Comet assay beskrevet av Narendra Singh, Ray Tice og medarbeidere (6), og det er i hovedsak denne versjonen som er i bruk i dag. Typiske bilder av dette alkaliske Comet assayet er vist i figur 2.
Assayet brukes i dag over hele verden. Det kan brukes for praktisk talt alle vev som lar seg løse opp til enkeltceller eller enkeltkjerner – inkludert planter, invertebrater (virvelløse dyr) og vertebrater (virveldyr). Det er enkelt, sensitivt, raskt, økonomisk og gir gode bilder. Det skårer høyere på nøyaktighet enn mer analytiske kromatografiske teknikker ved måling av lave nivåer av DNA-oksidasjon (7).
Modifisert Comet assay for måling av spesifikk skade
Comet assay, som beskrevet over, brukes for å påvise DNA-brudd. Den alkaliske versjonen påviser i tillegg alkalielabile seter, særlig DNA-seter hvor basen har gått tapt. Det kan enten ha skjedd spontant, som et resultat av DNA-skade eller i et mellomliggende stadium av base-eksisjons-reparasjon (BER). I tillegg kan modifiserte baser påvises ved innføring av et ekstra trinn; etter lysering blir nukleoidene kuttet med et enzym som danner DNA-brudd ved en spesifikk DNA-lesjon (se figur 3). De bakterielle DNA-reparasjonsenzymene formamidopyrimidine DNA glycosylase (FPG) og endonuklease III (endoIII) kjenner igjen henholdsvis 8-oksoguanin og andre oksiderte pyrimidiner. T4-denV-enzymet danner brudd ved seter der det har blitt dannet UV-induserte pyrimidindimerer. For å estimere frekvensen av oksiderte guaniner, inkuberer vi parallelle plater med buffer eller FPG, det måles prosent hale-score for hver av dem, og score for bufferprøvene trekkes fra score for FPG-prøvene. På den måten får vi ”netto FPG-sensitive seter”.
Begrensninger
Comet assay har noen begrensninger. Protokollene - og dermed også resultatene - varierer mellom ulike laboratorier. Det jobbes stadig med å standardisere metoden, og det er nødvendig å bruke referanseprøver (celler med kjent nivå av skade) som kontroll. I noen tilfeller er det nødvendig å referere til en kalibrert størrelse – vanligvis ved hjelp av ioniserende stråling – for å gjøre om prosent hale-DNA til en faktisk bruddfrekvens per celle eller per 109 Dalton.
Dataene fra Comet assay er pålitelige hvis man tar hensyn til:
- AP-seter er alkalielabile og framstår dermed som DNA-brudd
- Mange av enzymene som brukes er ikke helt spesifikke
- Det nøytrale Comet assay kan detektere både enkelt- og dobbelttrådige brudd
- Fragmentering av DNA under apoptose ligger langt over deteksjonsvinduet med standard protokoll for Comet assay.
Måling av DNA-reparasjon
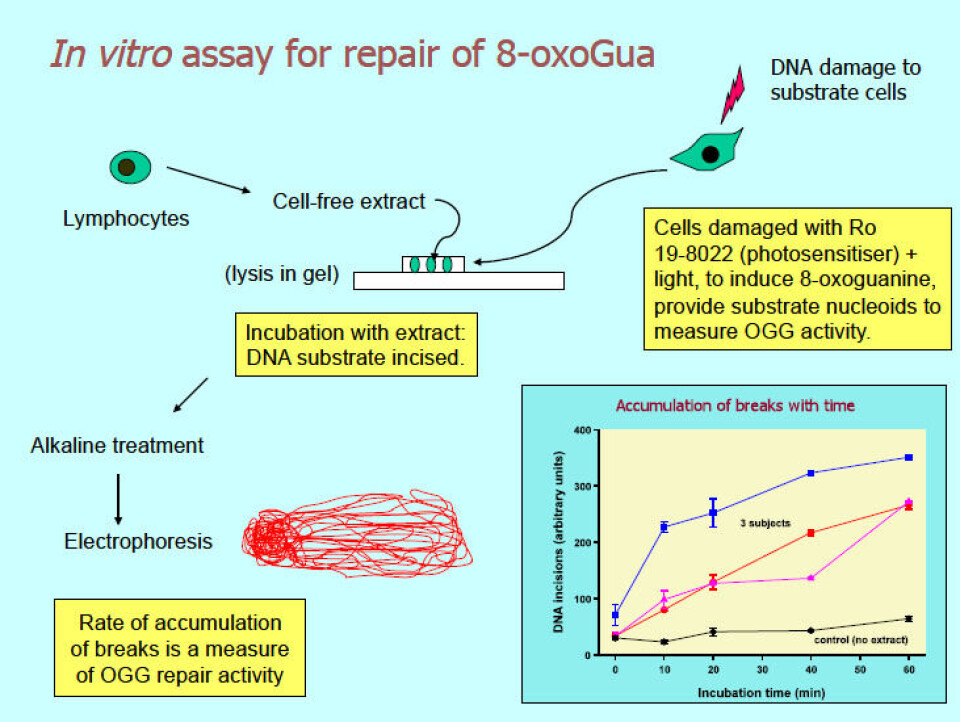
Det finnes to måter å måle cellenes kapasitet til DNA-reparasjon med Comet assay. Dersom cellene blir inkubert med DNA-skadende agens, vil resterende skade målt i intervaller med det alkaliske Comet assay angi reparasjonskinetikken. Skjøting av trådbrudd, indusert av stråling eller H2O2, blir etterfulgt av Comet assay. Reparasjon av 8-oksoguanin krever bruk av FPG for å måle resterende enzymsensitive seter. En fordel med Comet assay er at det kan følge svært lave nivåer av reparasjon - i motsetning til andre mindre sensitive metoder som bare måler svært høye doser av skade. Den andre metoden er in vitro reparasjonsassay (8) (figur 4). Et celleekstrakt inkuberes med et DNA-substrat med spesifikke lesjoner. Substratet foreligger som nukleoider innkapslet i agarose fra celler behandlet med DNA-skadende agens. Reparasjonsenzymer i celleekstraktet snitter DNA, og bruddene som hoper seg opp måles med Comet assay. Dersom substratet inneholder 8-oksoguanin, kan man måle celleekstraktets kapasitet for base-eksisjons-reparasjon (BER), eller spesielt aktiviteten til enzymet 8-oksoguanin-glykosylase. UV-bestrålte substratceller brukes for å måle nukleotid-eksisjons-reparasjon (NER).
Forbedring av Comet assay
Et begrenset antall prøver kan analyseres med Comet assay, avhengig av størrelsen på elektroforesekaret og antallet geler på hver plate. Forfatterne av denne artikkelen har ledet et europeisk ”strategic targeted research project”, for å øke utbyttet av assayet. Prosjektet er del av et forskningsprogram som skal finne alternative metoder til dyreforsøk når det gjelder sikkerhetsvurdering av kjemikalier. Europakommisjonen er forpliktet til å redusere bruken av forsøksdyr, samtidig som det er bestemt at tusenvis av kjemikalier skal sikkerhetstestes for generell bruk (REACH-programmet). Det er derfor et stort behov for alternative metoder. Ettersom DNA-skade er et avgjørende aspekt ved kreftutvikling, kan Comet assay utgjøre én del av et batteri av tester til genotoksisitetsvurdering. Å øke antallet geler som kan kjøres i hvert kar, vil gjøre Comet assay mer anvendelig for testing i høy skala. Vi har økt antallet geler på hver plate til 12 (se figur 5) (9), med plass til 20 plater i hvert kar. Det totale antallet prøver i hver elektroforese er dermed økt til 240. En ytterligere økning i antallet prøver kan oppnås med et multibrønnsarray på GelBond plastfilm; fire GelBond-ark får plass i ett kar, noe som gir en maksimumskapasitet på 348 geler i ett eksperiment.
Økt ytelse for assayet skaper et behov for automatisert bildeanalyse, for eksempel ved bruk av systemet Pathfinder TM (IMSTAR SA).
Andre bruksområder
I tillegg til genotoksisitetstesting har det forbedrete assayet åpenbare bruksområder innen human biomonitorering, hvor et høyt antall prøver må analyseres. DNA-skade i perifere lymfocytter blir ofte brukt som biomarkør for eksponering til genotoksiske miljøagenser, blant annet eksponering på arbeidsplassen. Kapasitet for DNA-reparasjon blir i stadig større grad sett på som en viktig biomarkør i molekylær epidemiologi.
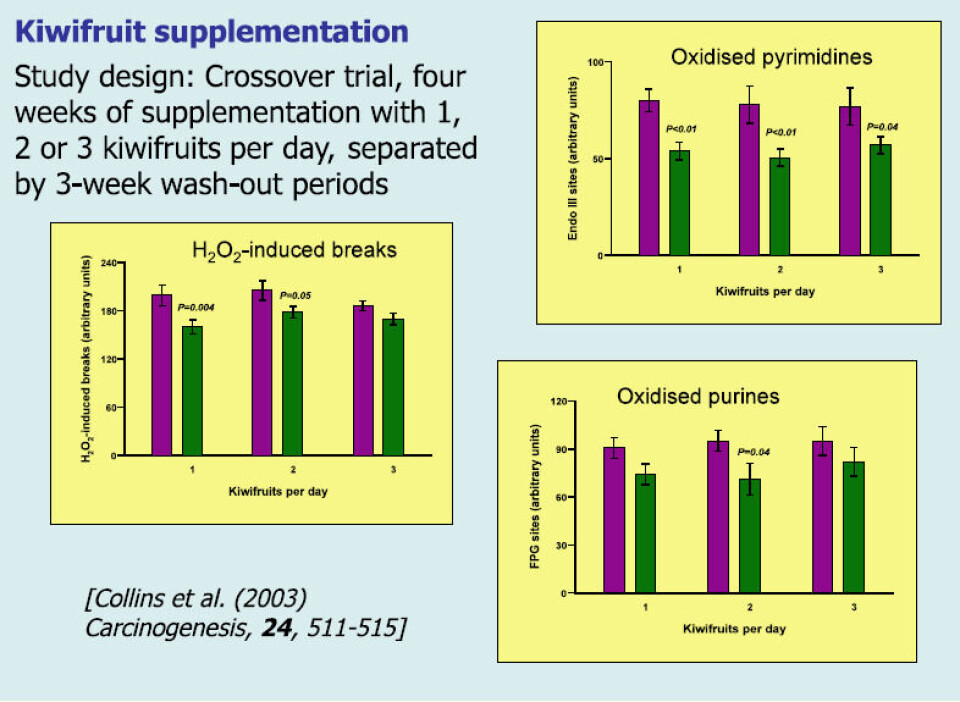
Comet assay har vært spesielt nyttig i ernæringsstudier. Vi var de første til å demonstrere fall i endogen DNA-oksidasjon etter inntak av kosttilskudd med antioksidanter, C- og E-vitamin og ß-karoten (10). En studie involverte kiwi som tillegg i kosten (11). Frivillige ble daglig gitt en, to eller tre kiwier i fire uker. Studien hadde et crossoverdesign, slik at deltakerne mottok dosene med frukt i ulik rekkefølge. Etter testing av lymfocyttene fant vi en senket endogen DNA-oksidasjon (FPG- og endoIII-sensitive seter) og økt motstandskraft mot oksidasjon ved H2O2 in vitro – noe som antyder en samlet økning i antioksidantstatus (figur 6).
I tillegg brukte vi in vitro-assayet for å studere base-eksisjons-reparasjon (BER) på prøvene, og vi fant en signifikant økning i reparasjonskapasitet etter alle kiwi-dosene. Disse assayene kan også brukes på celler i kultur, og vi undersøkte nylig effekten av -cryptoxanthin (et karotenoid som finnes i noen sitrusfrukter og i papaya), på to humane transformerte cellelinjer – HeLa og Caco2 (12). I hver cellelinje beskyttet -cryptoxanthin DNA mot bruddskade indusert av H2O2, og mot 8-oksoguanin indusert av behandling der cellene ble gjort lysømfintlige og utsatt for lys. Karotenoidet akselererte også skjøting av trådbrudd og fjerning av FPG-sensitive seter (8-oksoguanin). Denne effekten på cellulær reparasjon ble speilet i en økt aktivitet av reparasjonsenzymer i celleekstrakter. Ernæringsfaktorers evne til å modulere DNA-reparasjon legger en ny dimensjon til forbindelsen mellom kosthold og kreft, som inntil nylig hovedsakelig har vært konsentrert om antioksidantegenskapene som er til stede i det meste av frukt og grønnsaker. Det er imidlertid nødvendig med flere studier for å slå fast om den økte reparasjonen er et generelt kjennetegn ved disse mattypene, eller om det skyldes enkelte spesifikke bestanddeler i maten. Vi vet heller ikke om nukleotid-eksisjons-reparasjon (NER) blir påvirket på samme måte.
Det gjenstår å implementere Comet assays potensial for bruk i klinisk diagnostikk, eller for å forutsi sensitiviteten for kreftbehandling (13).
Et spennende bruksområde som ikke er fullt utnyttet, er bruk av Comet assay for å overvåke virkningen av miljøforurensning på dyrelivet (14). Noen organismer (overvåkings/sentinel-organismer) kan brukes som indikatorer på tilstedeværelse av skadelige stoffer. Slike overvåkingsdyr (for eksempel muslinger, meitemark eller mus) som lever i et forurenset område, kan oppvise økte nivåer av DNA-skade i leukocytter (eller tilsvarende celler i invertebrater), sammenlignet med dyr som lever i et ”rent” kontrollområde. Resultatene indikerer ikke bare en mulig trussel mot dyrelivet, men viser også en mulighet for ekstrapolering til mennesker som bor i det samme forurensete området.
Konklusjon
Comet assay er et sensitivt, allsidig assay for å detektere trådbrudd i DNA og endrete DNA-baser, og er særlig anvendelig for å måle de lave nivåene av DNA-skade som normalt kan finnes i levende celler. Bruksområder inkluderer biomonitorering, økogenotoksisitet, testing av kjemikalier for genotoksiske effekter (in vitro, eller in vivo i gnagere), og grunnforskning på DNA-skade og DNA-reparasjon.